选项 | 实验操作 | 现象 | 结论 |
A | 向一密闭容器充入NO2 , 保持温度不变,扩大容器体积 | 容器中气体颜色先变浅后变深 | 平衡2NO2(g) |
B | 向2mL5%H2O2溶液中分别滴加5滴等浓度的FeCl3和KMnO4溶液 | 加入KMnO4溶液的反应更剧烈 | KMnO4比FeCl3催化效果好 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 玻璃球中红棕色加深 | 反应2NO2(g) |
D | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液红色变浅 | 增大生成物浓度,平衡逆向移动 |

时间 | |||||
0 | 0.50 | a | 0.75 | 0.75 | |
1 | 0.50 | 0.35 | 0.25 | 0.25 |
①内,
。
②末时,混合气体中
的物质的量分数为。已知:B的物质的量分数
。
③第时
第
时
(填“>”、“<”或“=”)第
时,
(填“>”、“<”或“=”)
a.容器内气体的密度不再变化
b.容器内气体的平均相对分子质量不再变化
c.的体积分数不再变化
d.断裂个
键的同时生成
个水分子
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= , 写出此反应的热化学方程式:。
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
①a=kJ·mol-1 , 改变下列“量”,一定会引起ΔH发生变化的是(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
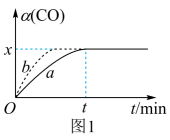
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是加入催化剂或者。
②在此温度下,该可逆反应的平衡常数K=(用含x的代数式表示)。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是。
①甲同学根据中学所掌握知识预测红色应该(填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中、银氨溶液中
、
、
等。因此预测红色应该(填“变深”“变浅”或“不变”),理由:。

①用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是。
②浸渣的主要成分为(填化学式)。
①用溶液将
氧化为
, 反应的离子方程式为。
②实际用量比理论上多的原因是(用化学方程式解释)。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为(填字母)。
A. 4.0左右 B. 5.0左右 C. 6.0左右
②检验Fe3+沉淀完全的实验方法为。