①1
②
③
④
①该电池放电时正极反应式为。
②放电时每转移3mol电子,正极有mol被还原。

A.Pb为电池的负极,发生氧化反应,电极方程式为:
B.铅蓄电池放电时,正、负电极质量均增大
C.铅蓄电池放电时,定向移动去
极
D.放电过程中,正极区附近pH减小

①a极通入的物质为(填物质名称),电解质溶液中的OH-移向 (“负”或“正”。
②写出此甲烷燃料电池工作时负极的电极反应:。

2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g)ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为kJ·mol-1。

①从实验装置上看,图中玻璃搅拌器的作用是。
②简易量热计如果不盖杯盖,生成1 mol H2O(l)时所测得中和反应的反应热(ΔH)将(填“偏大”“偏小”或“不变”),判断的理由是。
③若用等体积等物质的量浓度的CH3COOH进行上述实验,生成1 mol H2O(l)时,所测得的中和反应的反应热的绝对值(|ΔH|)将(填“偏大”“偏小”或“无影响“),判断的理由是。
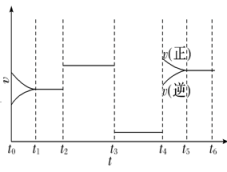
2A(g)+B(g)3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
①t3时改变的条件为,t4时改变的条件为。
②a(填“>”或“<”)0。

