 竹作笔杆羊毛为毫
B .
竹作笔杆羊毛为毫
B .  杂木烧炭集烟成墨
C .
杂木烧炭集烟成墨
C .  浆压薄片晾干成纸
D .
浆压薄片晾干成纸
D .  开石磨光做成砚台
开石磨光做成砚台
3月30日,神舟十五号航天员乘组进行了第三次出舱活动,完成了所有既定任务。此外,“天宫课堂”也已顺利完成三次授课。航天员工作的顺利开展得益于空间站“再生生保系统”的助力。


①下列肥料属于复合肥的是(填字母)。
A.CO(NH2)2 B.Ca3(PO4)2 C.NH4NO3 D.KNO3
②草木灰是一种钾肥,主要成分是碳酸钾,一般不与铵态氮肥混合使用。据此推测,碳酸钾溶液中的阴离子主要是。
自然界中,绿色植物实现二氧化碳到氧气的转化过程称为。
实验室制取气体的常见装置如图所示,请回答下列问题:


利用高锰酸钾法制取并收集纯净的氧气,可选用的装置组合为(填字母),反应的化学方程式为。为了防止加热时固体粉末随气流进入导管,应在放一团蓬松的棉花。
便携式氧气罐和家用制氧机常用于家庭或高海拔地区的临时供氧。
氧气能被压缩在便携氧气罐中,从分子的角度解释,其原因是,验证罐内的气体是氧气的方法是:按压喷气口,。
【查阅资料】制氧时,在反应仓中依次发生两个反应:
、
。
【实验探究】对比过碳酸钠和过氧化氢溶液的制氧效果。
计算:①13.6mL5%过氧化氢溶液(密度近似为1g/mL),最多可制得氧气的质量是多少?。
②获取上述相同质量的氧气,需要过碳酸钠的质量是多少?。(写出计算过程,结果保留两位小数)
实验:①将上述质量的过碳酸钠配制成13.6mL水溶液。
②另取13.6mL5%过氧化氢溶液。
③向上述两种溶液中分别加入0.2g二氧化锰,用排水法收集并读取每2分钟获得的氧气体积。
④根据测得前20分钟的实验数据绘制曲线,如图所示。

【实验结果】分析曲线,并得出结论,

其中x=,以上三种原子在化学反应中易(填“得到”或“失去”)1个电子,这些元素具有相似的化学性质的原因是。


①写出上述过程中的两个化学反应方程式:;。
②经过这两个反应,可达到的目的是。


①温度在250℃~280℃范围内,CO2的转化率升高但含碳产物中CH3OH的含量却下降的原因可能是。
②实际反应时可能会发生积炭,生成的碳会降低催化剂的活性,适当通入过量二氧化碳可以有效缓解积炭,原因是。
【查阅资料】①MgO、Mg(OH)2均为白色固体;Mg2(OH)2CO3为黑色固体。
②部分物质的熔沸点。
Mg | MgO | |
熔点 | 651 | 2852 |
沸点 | 1170 | 3600 |
【实验探究】用如图1所示进行实验(镁条固定在试管塞上),并进行了一周的观察。

试管编号 | 实验现象 |
A | 镁条表面无明显变化 |
B | 镁条表面不再光亮 |
C | 镁条表面不再光亮 |
D | 第二天表面有少量黑斑,后不再增加 |
E | 第二天表面有少量黑斑,后不再增加 |
F | 第二天开始表面有黑斑产生,第7天时表面完全变黑 |
乙同学提出有气泡产生并不能说明黑色物质中有碳酸盐,原因是。

镁条燃烧后所得固体产物的质量小于镁条的质量,原因可能是。
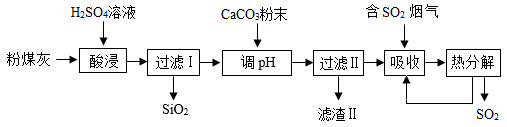
已知:SiO2是一种难溶于酸的固体。
酸浸时Al2O3发生反应的化学方程式为。
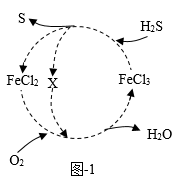

一种用氯化铁溶液循环脱硫工艺的物质转化如图1所示。
①图1中X物质可能是(填化学式)。
②写出该脱硫总反应的的化学方程式:。