温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
硝酸钾溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 |
氯化铵溶解度/g | 29.4 | 33.2 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 60.2 | 65.6 | 71.2 | 77.3 |
樟脑( )是一种白色晶体,易溶于酒精、难溶于水。
)是一种白色晶体,易溶于酒精、难溶于水。

回答下列问题:
①属于芳香族化合物 ②能与NaHCO3溶液反应产生CO2 ③含有碳碳三键

①苯酐与乙醇反应的化学方程式为。
②使用5%的碳酸钠溶液进行“洗涤”的目的是。

回答下列问题:
(已知:I2+I- I
;可选用的试剂:5%淀粉溶液、0.1 mol·L-1NaNO2溶液、0.1mol·L-1Na2SO3溶液、6mol·L-1H2SO4溶液)
①取样品,加入CCl4振荡、静置,可观察到下层呈紫红色;
②分液后取上层黄色液体,滴入适量(填选用的试剂,下同),可观察到;
③重复上述操作2~3次,直至步骤②中没有明显现象;
④再滴加适量,若观察到溶液变蓝,证明氟硅酸溶液中存在I。

已知:①氧化还原反应可以拆分为两个半反应,标准电极电势分别表示为φθ(+)、φθ(-),标准电动势Eθ=φθ(+)-φθ(-),如
Zn+Cu2+=Zn2++Cu的 Eθ=φθ(Cu2+/Cu)—φθ(Zn2+/Zn)。
②Eθ>0,该反应能自发进行,Eθ>0.3V,反应趋于完全进行。
③φθ(I2/I-)=0.54V φθ(IO-/I2)=0.45V φθ(IO/I2)=0.21V
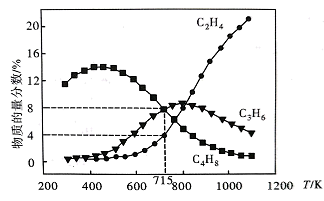
反应I 2CH3I(g)C2H4(g)+2HI(g) ΔH1Kp1=a
反应Ⅱ 3C2H4(g)2C3H6(g) ΔH2Kp2=b
反应Ⅲ 2C2H4(g)C4H8(g) ΔH3Kp3=c
反应I、Ⅱ、Ⅲ在不同温度下的分压平衡常数Kp如表1,回答下列问题:
表1
T/Kp | 298 K | 323 K | 423 K | 523 K | 623 K | 723 K |
反应I | 7.77×10-8 | 1.65×10-6 | 1.05×10-2 | 2.80 | 1.41×102 | 2.64×103 |
反应Ⅱ | 7.16×1013 | 2.33×1012 | 1.48×108 | 3.73×105 | 6.42×103 | 3.40×102 |
反应Ⅲ | 2.66×1011 | 6.04×109 | 1.40×105 | 1.94×102 | 2.24 | 8.99×10-2 |
则Kp4=(用含有b、c的代数式表达),结合表1数据分析 ΔH40。
p/MPa | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
1.42 | 1.75 | 1.98 | 2.15 | 2.30 | 2.42 | 2.53 | 2.63 | 2.72 | 2.80 |
随压强增大不断增大的原因可能是。