
仪器a的名称是。
实验数据如表所示:
|
实验编号 |
电压/V |
pH |
阳极现象 |
阴极现象 |
|
1 |
1.5 |
5.52 |
无气泡,滴加KSCN显红色 |
无气泡,银白色金属析出 |
|
2 |
3.0 |
5.52 |
少量气泡,滴加KSCN显红色 |
无气泡,银白色金属析出 |
|
3 |
4.5 |
5.52 |
大量气泡,滴加KSCN显红色 |
较多气泡,极少量金属析出 |
|
4 |
1.5 |
1.00 |
无气泡,滴加KSCN显红色 |
较多气泡,极少量金属析出 |
①由实验1、2现象可以得出结论:增大电压,优先于放电;
②若由实验1、4现象可以得出结论:。
|
实验编号 |
c(NH4Cl)/mol·L-1 |
温度/℃ |
待测物理量 |
实验目的 |
|
5 |
0.5 |
30 |
a |
-- |
|
6 |
1.5 |
i |
b |
探究浓度对氯化铵水解平衡的影响 |
|
7 |
0.5 |
35 |
c |
ii |
|
8 |
2.0 |
40 |
d |
探究温度、浓度同时对氯化铵水解平衡的影响 |
该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol·L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量”是;
②实验目的ii是;
③上述表格中,bd (填“>”、“<”或“=”)。
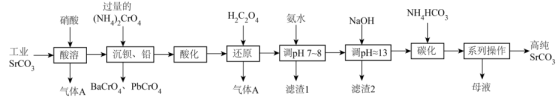
已知:①Sr(OH)2 为强碱,Cr(OH)3 为两性氢氧化物;
②常温下,各物质的溶度积常数如表所示。
|
化合物 |
Cr(OH)3 |
Ca(OH)2 |
Mg(OH)2 |
SrCO3 |
|
Ksp近似值 |
1×10-31 |
5.5×10-6 |
1.8×10-11 |
5.6×10-10 |
回答下列问题:

CO2(g)+H2(g) CO(g)+H2O(g) △H2 =b kJ·mol-1
2CO(g)+O2(g) 2CO2(g) △H3=c kJ·mol-1
则催重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=kJ·mol-1

①判断该反应的△H0 (填“>”、“<"或“=”),比较压强的大小: p1 p2 (填“>”、“<”或“=”)
②在恒容容器中进行该催化重整反应(不考虑其他反应),下列能说明该反应处于化学平衡状态的是 (填字母)。
A.CO2的质量分数保持不变.
B.容器中CO与H2的百分含量之比保持不变
C.v正(CH4)= 2v逆(CO)
D.容器中混合气体的平均相对分子质量保持不变
③X点对应的初始投料比n(CH4)/n(CO2)=1,平衡压强为P4,温度为950℃,则X点平衡常数Kp=


电解过程中阳极电极反应式为。
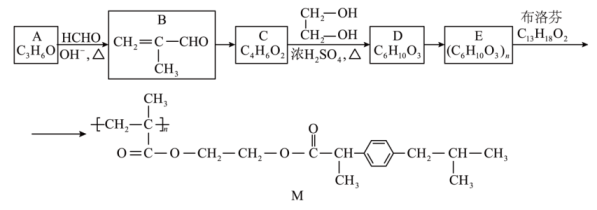
已知: CH3CHO CH3CH=CHCHO
(i)分子中含有苯环;(ii) 能与NaHCO3溶液反应放出气体;(iii)分子中只有4种不同化学环境的氢原子。
 的合成路线(其它试剂任选,可不注明反应条件)。
的合成路线(其它试剂任选,可不注明反应条件)。