
回答下列问题:

①仪器X的名称为,干燥管中盛装的试剂为。
②N2H4的电子式为。
③反应过程中,如果分液漏斗中溶液滴速过快,部分N2H4·H2O与NaClO反应产生大量氮气,该化学反应方程式为。
④蒸馏获得水合肼粗品后,剩余溶液进一步处理还可获得副产品NaCl和Na2CO3 , NaCl和Na2CO3的溶解度曲线如图2所示。获得NaCl粗品的操作是、 、洗涤、干燥。

①滴定时,碘的标准溶液盛放在 (填 “酸式”或“碱式”)滴定管中。
②实验测得消耗I2溶液的体积为18.00 mL,馏分中N2H4·H2O的质量分数为。 (已知:N2H4·H2O +2I2=N2 ↑+ 4HI+H2O)
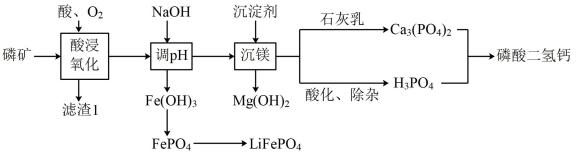
已知: Ksp[Fe(OH)3]=1×10-38 , Ksp[Mg(OH)2]= 1 ×10-11。
回答下列问题:

已知: i. CO(g)+NO2(g) CO2(g)+NO(g) ΔH1= -15.9 kJ·mol-1
ii.2CO(g)+ 2NO(g) 2CO2(g)+N2(g) ΔH2= -623 kJ·mol-1
iii. 4CO(g)+ 2NO2(g) 4CO2(g)+N2(g) ΔH3
回答下列问题:

a. N2O比![]() 更容易与CO发生反应
更容易与CO发生反应
b.整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
c.其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率

①该反应化学平衡常数的表达式K=;
②前2 min内的平均反应速率v(NO)= ;
③8 min时,若改变反应条件,导致N2的物质的量发生如图所示的变化,则改变的条件可能是。

a.非极性键 b.π键 c.离子键 d.氢键 e.配位键



已知:R-CHO+![]()
![]()
回答下列问题:
①苯环上只有两个取代基;
②能发生银镜反应、能与碳酸氢钠溶液反应、能与氯化铁溶液发生显色反应;
③核磁共振氢谱有六组峰、峰面积之比为1:1:1:1:2:2。