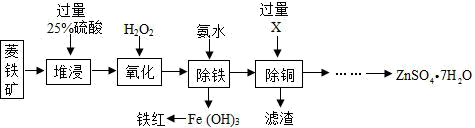
|
编号 |
反应温度/℃ |
溶液 pH |
除铁率/% |
|
a |
30 |
2 |
91.5 |
|
b |
30 |
2.5 |
93.3 |
|
c |
40 |
2.5 |
95.1 |
|
d |
40 |
3.1 |
Y |
|
e |
50 |
3.1 |
99.5 |
①实验对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高。
②实验 a 和实验 b 对比,得到结论是。
③最佳的除铁条件为反应温度℃,溶液 pH。
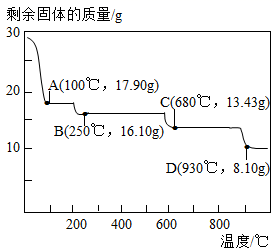
ZnSO4•7H2O 加热到 100℃时所得固体的化学式为是(写出计算过程)。