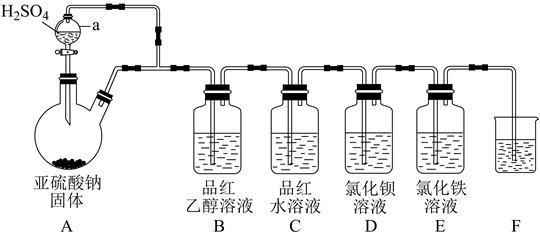

①装置中浓硫酸的作用为。
②根据表中实验现象做出合理解释。
| 组别 | 实验现象 | 合理解释 |
| 甲 | 品红溶液几乎不褪色 | 反应方程式为 |
| 乙 | 品红溶液随时间的推移变得越来越浅 | 原因可能是 |
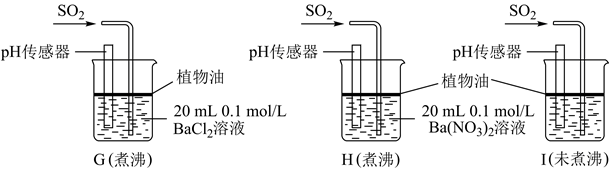 实验中G、H、I烧杯中观察到的现象如表:
实验中G、H、I烧杯中观察到的现象如表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测的溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
①据G中现象推测D中产生的白色沉淀的化学式是。
②写出H中白色沉淀产生的离子方程式。
③据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是。