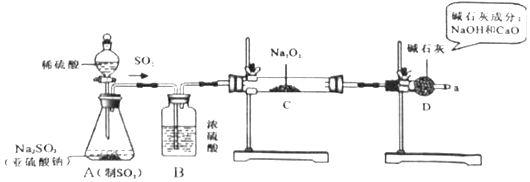
【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO2+2Na2O2=2Na2SO3+O2 , 2Na2SO3+O2=2Na2SO4;SO2能使品红溶液褪色.
猜想2:固体成分为Na2SO4
猜想3:
【实验结论】
(1 ) A是制取SO2气体的装置,反应的化学方程式与实验室制取CO2的化学方程式类似,请写出A中发生反应的化学方程式:.
(2 )由题中的实验现象,可推测猜想2是错误的.
(3 )装置B的作用是;装置D的作用是.
(4 )根据反应前后固体的质量,可计算出Na2SO3的质量为g,Na2SO4的质量为g.
(1 )若实验前称得Na2O2固体的质量为m1g,充分反应后称得生成物固体质量为m2g,则m2的取值范围是(用含m1的关系式表示)
(2 )请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分: