

①p1p2(填“>”、“<”或“=”).
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2 , 达到新平衡时,CO的平衡转化率(填“增大”、“减小”或“不变”). 
③在p1下,100℃时,CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数为(用含a、V的代数式表示).
关于该反应的下列说法中,正确的是 (填编号).
①从反应开始到平衡,CO2的平均反应速率v(CO2)=.
②下列措施中能使化学平衡向正反应方向移动的是(填编号).
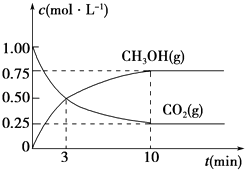
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CO2和3mol H2 .