向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.
针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
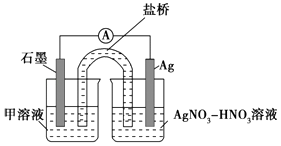
实验Ⅱ:装置如图.其中甲溶液是,操作现象是.