食盐
食盐是生活中常用的调味品,主要成分是氯化钠,在人体中有调节水分、维持酸碱平衡等生理作用。
资料一:食盐的加工
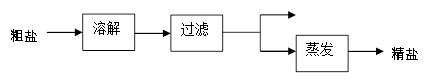
工业上用海水晒盐或用盐湖水、盐井水煮盐,使氯化钠晶体析出。这样制得的氯化钠含有较多的杂质,称为粗盐。粗盐经下图所示主要流程可成为精盐。
资料二:食盐的种类
市面上食盐制品种类繁多,现简要介绍几种。原盐,即粗盐,常用于腌制工艺;精盐,由粗盐提纯而成,适合烹饪调味;碘盐,在食盐中添加一定量碘酸钾(KIO3)即为碘盐,可防治碘缺乏病;低钠盐,食盐中添加氯化钾、硫酸镁等有“咸味”的成分,可防治因钠离子摄入过多而引起的高血压等疾病。
资料三:食盐的摄入量
虽然我们的身体离不开食盐,但摄入过多也会对身体产生危害。按照世界卫生组织的推荐标准,成人每天食盐摄入量不宜超过6g。然而据调查,我国人均每天的食盐摄入量为9.1g。一方面三餐中食盐量需要控制,另一方面,许多成品食物中食盐的含量也应引起重视,下表所示为部分成品食物每100g中的食盐含量。
食品 | 某品牌方便面 | 某品牌酱油 | 某品牌薯片 |
食盐含量g/100g | 3 | 16 | 1.6 |
依据文章内容回答下列问题。

I.探究制作“叶脉书签”的最佳条件
【查阅资料】
氢氧化钠溶液有腐蚀性。
【进行实验】
实验1:相同煮沸时间内,将洗干净的树叶放在不同浓度的氢氧化钠溶液里,处理后叶片变化如下表。
NaOH溶液浓度 | 1% | 5% | 10% |
叶片变化 | 留有很多叶肉 | 留有较多叶肉 | 残留很少叶肉 |
实验2:在10%的氢氧化钠溶液里,将洗干净的树叶进行不同时间的煮沸,处理后叶片变化如下表。
煮沸时间 | 5min | 15min | 20min |
叶片变化 | 留有较多叶肉 | 残留很少叶肉 | 叶片卷起来,叶肉与叶脉不易分离 |
【解释与结论】
【查阅资料】
a.氢氧化钠与氢氧化钙化学性质相似
b.稀盐酸与碳酸钠(Na2CO3)反应的化学方程式为:2HCl + Na2CO3=2NaCl + H2O +CO2↑
c.通常状况下,1体积的水约能溶解1体积二氧化碳
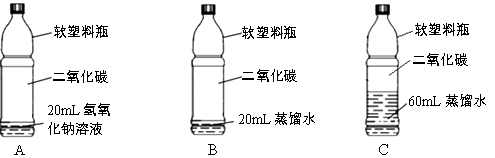
【猜想与假设】
氢氧化钠能与二氧化碳发生反应,其化学方程式为:2NaOH +CO2=Na2CO3 +
实验步骤 | 实验现象 |
| 无明显变化 |
甲同学发现实验步骤①中无明显变化,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,通过对比实验步骤②③证明NaOH与二氧化碳发生了反应。
实验步骤 | 实验现象 |
| A中有大量气泡产生, B中。 |
| 无明显变化 |
步骤②中通过B中实验现象,可知稀盐酸加入到步骤①所得溶液中有二氧化碳产生。
实验③的目的是排除的干扰。