
实验序号 | 1 | 2 | 3 | 4 | 5 |
加入CaCl2溶液质量/克 | 15 | 15 | 15 | 15 | 15 |
生成沉淀的总质量/克 | 4 | m | 10 | 10 | 10 |
求:

提示:
①食醋的主要成分是醋酸(HAc),醋酸和碳酸钙反应的化学方程式为:
CaCO3+2HAc═Ca(Ac)2+H2O+CO2↑
②鱼骨中其它成分与食醋反应生成的气体可忽略不计。
样 品 | 第 1 份 | 第2份 | 第3份 | 第4份 |
取样品质量(g) | 25.0 | 25.0 | 25.0 | 25.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.2 | 0.4 | 0.5 | m |
试计算:
测量次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的总质量(g) | 10 | 20 | 30 | 40 | 50 |
烧杯总质量(g) | 25.56 | 35.12 | 44.68 | 54.24 | 64.24 |
测量次数 | 第1次 | 第⒉次 | 第3次 | 第4次 | 第5次 | 第6次 |
加入氢氧化钡溶液质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
溶液总质量/g | 65.34 | 80.68 | 100.68 | 118.72 | 136.76 | m |
沉淀质量 | 4.66 | 9.32 | 9.32 | 11.28 | 13.24 | 13.24 |
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
第7次 |
|
加入盐酸的质量/g |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
|
锥形瓶中物质的质量/g |
80 |
110 |
140 |
170 |
197.8 |
226.7 |
a |
| 实验次数 | NaOH质量/g | FeCl3溶液质量/g | Fe(OH)3质量/g |
| 1 | 6 | 100 | 5.35 |
| 2 | 12 | 100 | 10.7 |
| 3 | 24 | 150 | 16.05 |
| 4 | 30 | 200 | a |
根据实验结果回答下列问题:
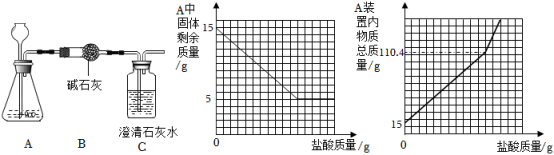
A装置中不再有气体产生时测得B装置质量增加了4.6g;C装置质量没有发生变化且无明显现象。请回答:
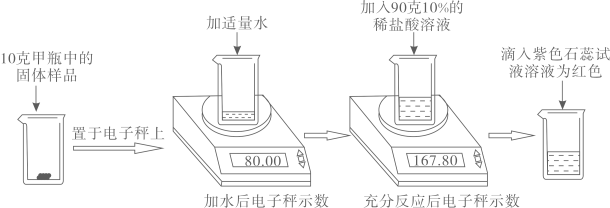


①检查装置气密性。
②注射器活塞推到底部,向装置内装入1.25g 磨成粉的珍珠样品,分液漏斗内加入足量稀盐酸,再次连接装置。
③打开分液漏斗活塞,将20mL足量稀盐酸加入装置后立即关闭活塞,充分反应后,观察到气泡不再产生,记录此时注射器的示数为240mL.资料:标准状况下,二氧化碳气体的密度约为2.0gL;珍珠粉中其它成分不与稀盐酸反应,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↓;甲装置固定装置略,不考虑活塞的摩擦和自重。