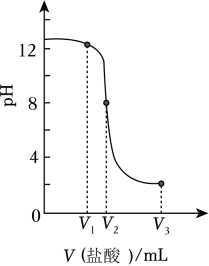
步骤1取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗m(HCl)=0.73g。
下列说法正确的是( )
 , 氯原子的结构示意图为
, 氯原子的结构示意图为 。
。①钠原子转变为钠离子时,发生变化的是 (填“质子数”或“电子数”)。
②x的数值为 。

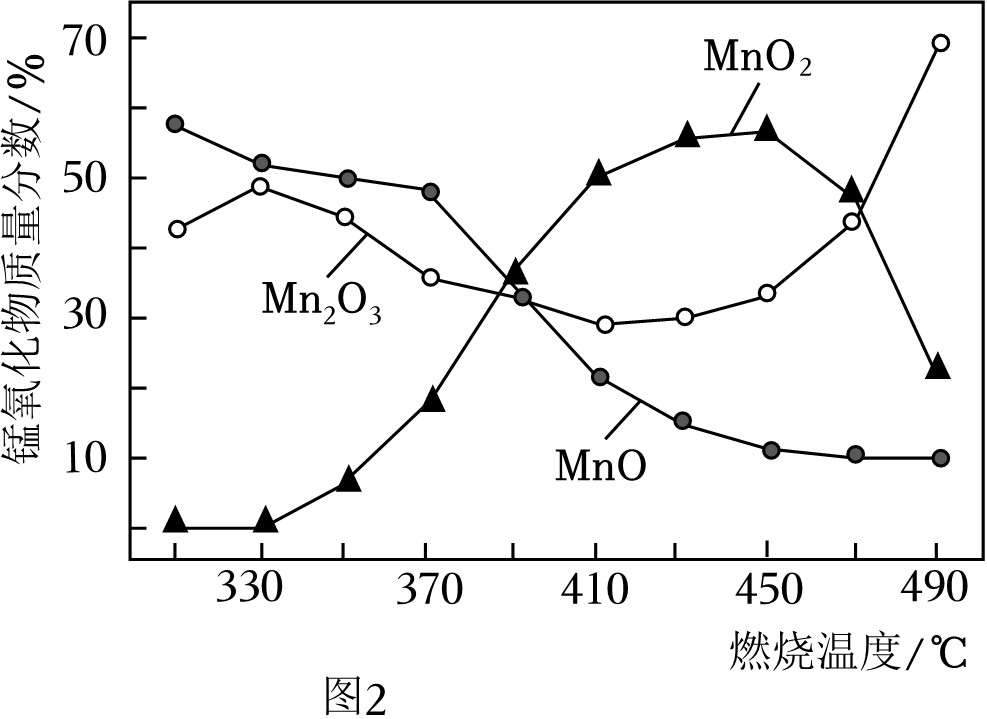
①370﹣410℃发生主要反应为2MnO+O22MnO2。该反应属于基本反应类型中的 反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的MnO2与KClO3混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。MnO2质量减少的主要原因是 。
①蜡烛属于 (填“混合物”或“纯净物”)。
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的 性。
①能说明蜡烛燃烧时放出热量的现象是 。
②正二十二烷(C22H46)是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同。写出正二十二烷完全燃烧的化学反应方程式:。
①蜡烛熄灭的可能原因有 。
②铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是 。

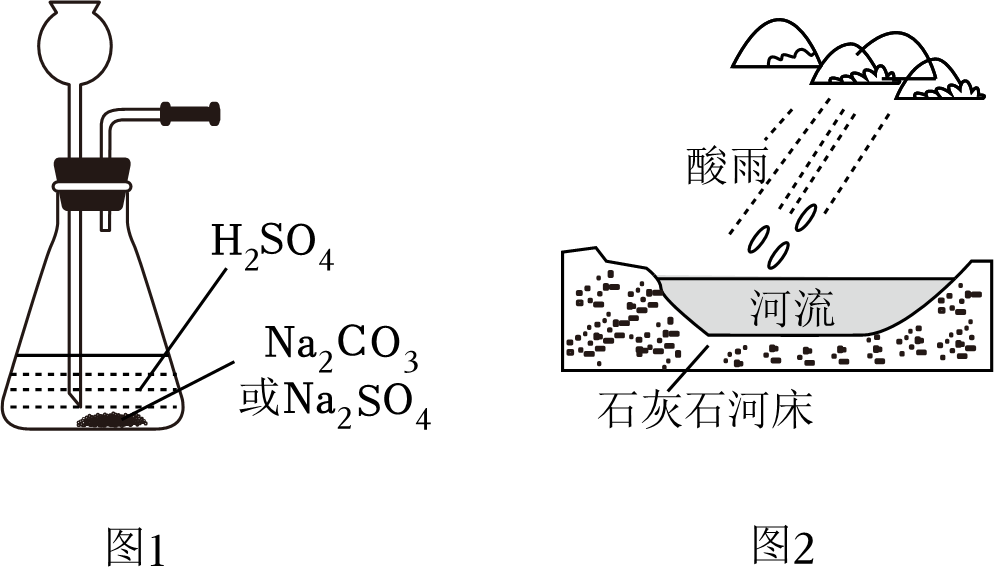
在常温、气体压强为101kPa时,1体积水里最多能溶解大约1体积CO2 或40体积SO2。学习小组利用图1所示装置制取CO2和SO2。
利用该装置制取CO2的化学反应方程式为 。在通风橱中分别向100mLH2O中通入CO2和SO2至饱和,用pH计测定饱和溶液pH,静置2h后,再次读取溶液pH。结果如表所示。
饱和溶液pH | 静置2h后溶液pH | |
CO2水溶液 | 3.94 | 4.12 |
SO2水溶液 | 0.88 | 0.79 |
①测定pH最简便的方法是使用pH试纸,操作时玻璃棒的作用是 (填字母)。
A.搅拌
B.引流
C.蘸取溶液
②静置2h后,CO2水溶液酸性 (填“增强”或“减弱”)。
③有同学根据溶液的pH认为CO2也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:。
【提出问题】该沉淀是什么?
【查阅资料】①SO2水溶液、BaSO3都能与O2发生氧化反应。
②BaSO3和BaSO4都难溶于水。
③BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸。
【提出猜想】沉淀可能为BaSO4或BaSO4、BaSO3的混合物。
【实验验证】请设计实验验证沉淀中一定含有BaSO4。简述实验过程(包括操作和现象):。(实验中须使用的试剂:10%的盐酸)