A. B.
C.
D.
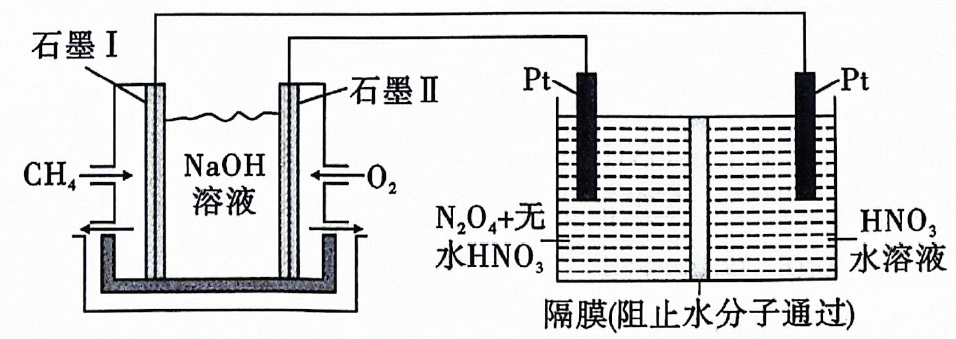
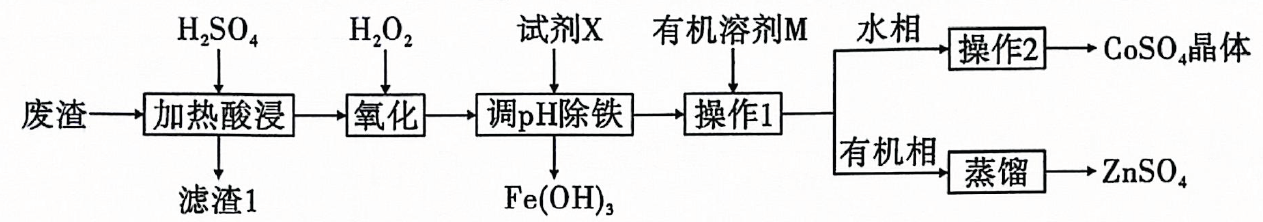
相关金属离子形成氢氧化物沉淀的
范围如下表:
金属离子 | ||||
开始沉淀的 | 7.15 | 6.3 | 1.5 | 6.2 |
沉淀完全的 | 9.15 | 8.3 | 2.8 | 8.2 |
A. B.
C.
D.
第二步: .
则 .
第二步能自发进行的条件是(填“高温”“低温”或“任何温度”).
①的平均反应速率
.
②下列能说明上述反应达到平衡状态的是(填序号).
A.混合气体的密度不再发生变化
B.
C.的体积分数在混合气体中保持不变
D.单位时间内消耗的同时生成
物质的起始浓度/ | 物质的平衡浓度/ | ||
0.6 | 0.3 | 0 | 0.2 |
温度为时,
(填数据);当温度升高为
时,
分别增大m倍和n倍,则mn(填“>”“<”或“=”).
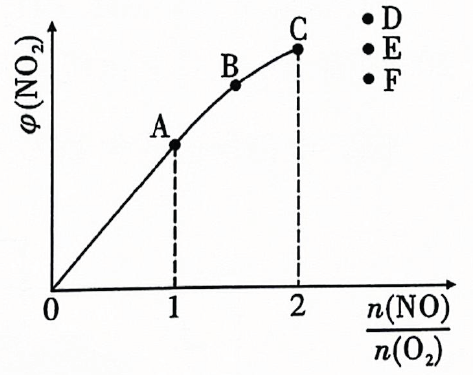
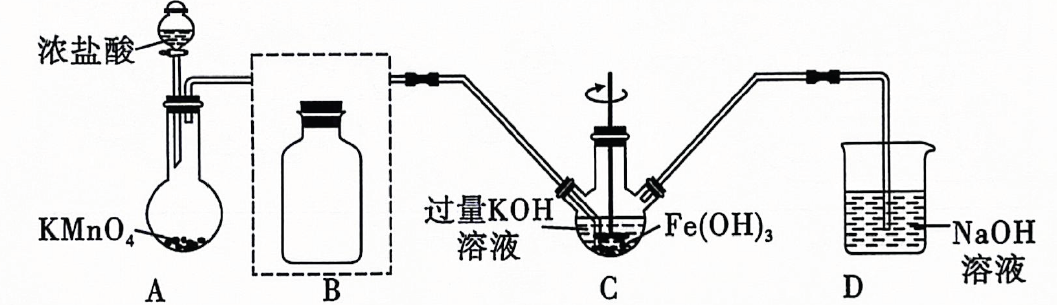
①;
②;
③ .
该粗产品中的质量分数为(用含w、c、V的代数式表示),若滴定管没有用标准液润洗,则测得的结果(填“偏高”“偏低”或“无影响”).