| | | | |
| A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
请回答下列问题:
已知:
;
。
写出焦炭与水蒸气反应的热化学方程式:。
①NO在催化条件下分解,反应在恒温密闭容器中下进行:
;某温度下,NO平衡转化率为10.0%,该温度下的平衡常数为,若某时刻
、
、
分别为2.0mol、1.0mol、0.50mol,此时反应(填序号)。
a.向逆反应方向进行
b.向正反应方向进行
c.达到平衡状态
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:。已知该反应的
, 简述该设想能否实现的依据:。
向体积为2L的密闭容器中充入2molCO和 , 测得不同条件下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
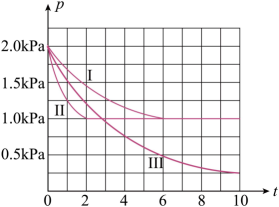
①Ⅱ和Ⅰ相比,改变的反应条件是;
②若反应Ⅰ的温度(),反应Ⅲ的温度(
),则
(填“小于”、“大于”或“等于”),简要说明判断依据:。

①反应的平衡常数为
;
②反应的平衡常数为
;
则:反应的化学平衡常数
(用含
和
的代数式表示)。
Ⅰ.下列描述不能说明反应达到平衡状态的是。
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与的浓度相等 D.容器内CO的体积分数不再变化
Ⅱ.若CO的平衡转化率[]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:
(填“>”、“=”或“<”)。
温度下,测得起始压强
, 达平衡时
。
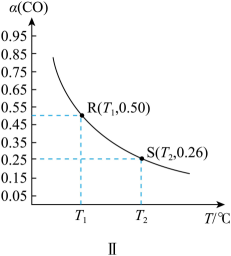
图1  图2
图2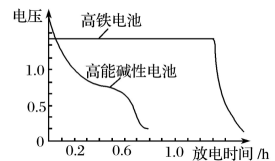
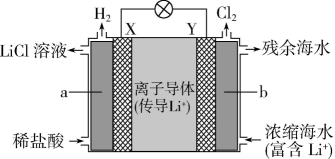
①该电池放电时正极反应式为。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向(填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有。
甲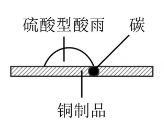 乙
乙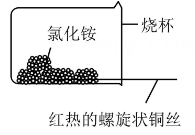
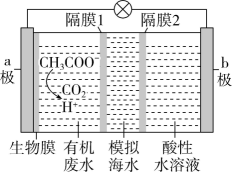
①如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生(填“氧化”或“还原”)反应,写出正极的电极反应式:。
②如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
生成,写出由黑色变为光亮红色过程中反应的化学方程式:。
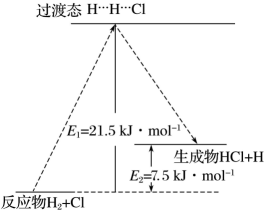
该基元反应的活化能为kJ/mol,为kJ/mol。
化学键 | ||||
键能/(kJ/mol) | 172 | 335 | 498 | X |
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中。