一、选择题<strong><span>(</span></strong><strong><span>本题包括</span></strong><strong><span>10</span></strong><strong><span>小题,每小题</span></strong><strong><span>2</span></strong><strong><span>分,共</span></strong><strong><span>20</span></strong><strong><span>分,每小题只有一个选项符合题意</span></strong><strong><span>)</span></strong>
-
1.
下列变化属于化学变化的是( )
A . 青稞酿酒
B . 从牛奶中打出酥油
C . 工业上分离液态空气制氧气
D . 活性炭净水
-
A . C2H6
B . C2H6O
C . C2H4
D . C2H4O
-
3.
观察和实验是学习化学的重要方式,下列实验现象描述正确的是( )
A . 细铁丝在氧气中燃烧,生成黑色固体四氧化三铁
B . 硫在空气中燃烧,产生蓝紫色火焰
C . 木炭在氧气中燃烧发出白光
D . 红磷在空气中燃烧,产生白雾
-
A . 因为镁带燃烧能产生耀眼的白光,所以可以用于制作照明弹
B . 因为氦气的密度小,所以常被用于填充探空气球
C . 因为氮气的化学性质稳定,所以充入包装袋内延长食品保存期限
D . 因为氧气能支持燃烧,所以常用作燃料
-
A . +6
B . +2
C . +3
D . +5
-
A . 反应前锥形瓶内白磷和氧气的总质量一定等于反应后生成五氧化二磷的质量
B . 白磷燃烧结束,锥形瓶应冷却后再放在天平上称量
C . 实验过程中气球先变大后变瘪
D . 瓶底的细砂起隔热作用
-
7.
如图是表示气体分子的示意图,图中“●”和“○”分别表示两种不同质子数的原子,其中表示化合物的是( )
-
8.
推理是一种重要的学习方法,下列推理正确的是( )
A . 单质是由同种元素组成的纯净物,所以由同种元素组成的物质不一定是单质
B . 离子是带电的原子或原子团,所以带电的粒子就是离子
C . 化学变化常伴随发光、发热的现象,所以有发光、发热的现象的一定是化学变化
D . 化学变化中,分子可分,原子也可分
-
9.
如图,该图能体现的知识有( )

①质量守恒定律;②化合物分子是由不同种原子构成的;③在化学反应中分子的种类发生了改变;④该反应可能是氢气与氧气的反应。
A . ①②③④
B . ①②③
C . ②③④
D . ②③
-
10.
在一密闭容器中放入下列物质,使其在一定条件下充分反应,测得数据如表:则下列说法正确的是( )
四种物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 25 | 15 | 1 | 5 |
反应后质量(g) | 11 | 未测 | 1 | 22 |
A . 未测值为3
B . 甲与乙反应的质量比为14:3
C . 丙一定是催化剂
D . 此容器中发生的反应是分解反应
二、填空题<strong><span>(</span></strong><strong><span>每空</span></strong><strong><span>1</span></strong><strong><span>分,共</span></strong><strong><span>27</span></strong><strong><span>分</span></strong><strong><span>)</span></strong>
-
-
12.
根据下列微粒的结构示意图,回答下列问题。

-
(1)
图中共表示了种元素的微粒,其中表示阴离子的是(填序号),其离子符号为,其中表示稀有气体原子的是(填序号)。
-
(2)
B属于元素(填“金属”“非金属”“稀有气体”),B与E在化学性质是否相似(填“是”“否”)。
-
-
13.
如图是某一变化过程的微观示意图(大的空心球代表氧原子,小的实心球代表氢原子),请回答下列问题:

该反应的基本类型是,生成物的分子数之比为。
-
14.
水是宝贵的自然资源,对人类的生产、生活都有重要的意义,请根据如图回答问题:如图是简易电解水装置图,正极和负极产生气体的体积比为
,该实验得出水是由
组成的.在此过程中,加入适量的氢氧化钠或硫酸钠的目的是
。检验正极气体的方法是
。
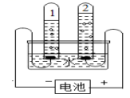
-
15.
卓玛收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成自来水。其实验过程如图所示。请回答以下问题:

-
-
(2)
操作②主要是除去水中的异味和色素,应选用的物质是。
-
(3)
卓玛发现经净化后的D是硬水,日常生活中常用的方法使硬水软化。
-
(4)
每一滴水都来之不易,列举一条生活中具体可行的节水措施:。
-
16.
扎西同学在实验室中用一种暗紫色固体粉末A进行探究实验,他实验的过程和现象如图,请你帮其解决下列问题:

-
-
(2)
写出下列化学反应符号表达式:
①固体C和F混合加热。
②铁丝在无色气体B中燃烧,该反应属于反应类型(基本反应类型)。
三、实验及探究题<strong><span>(</span></strong><strong><span>每空</span></strong><strong><span>1</span></strong><strong><span>分,共</span></strong><strong><span>23</span></strong><strong><span>分</span></strong><strong><span>)</span></strong>
-
17.
规范的实验操作是实验成功的保证,请填空:
-
(1)
取用药品时,若没有说明用量就按最少量取用,液体取mL。
-
-
(3)
酒精灯内的酒精若不小心洒出着火,可以用扑灭。
-
(4)
给试管中的液体加热,液体体积通常不超过试管容积的。
-
18.
回答下列问题:
-
(1)
做铁丝在氧气中的燃烧实验时在集气瓶的底部预先留少量水或铺一薄层细沙的原因是。做硫在氧气中的燃烧实验时集气瓶底也要留少量的水作用是。
-
(2)
向木炭燃烧完的集气瓶中倒入澄清石灰水看到的现象是。说明碳在氧气中燃烧生成了。
-
19.
在“质量守恒定律”的课堂教学中、甲、乙、丙、丁四个小组的同学分别做了A、B、C、D四个实验。他们都进行了规范的操作,准确的称量和细致的观察。

-
-
(2)
丙组同学认为C实验说明了质量守恒,请你从原子的角度说明守恒的原因:。
-
(3)
乙、丁两组同学得到的结论是:化学反应前后总质量不守恒。老师引导学生分析了B、D两个实验。你认为B实验天平不平衡的原因是。实验D中理论上镁条燃烧后的质量应该比反应前增重,原因是。
-
(4)
通过上述实验,得到的启示是:有气体参加或生成的反应,在验证质量守恒定律时应该在装置中进行实验。
-
20.
下列装置常用于实验室制取气体,请根据下列装置回答问题:

-
-
(2)
实验室用高锰酸钾制取干燥的氧气,收集装置应选(填字母代号,下同)装置,反应的文字表达式表示为。利用C装置收集氧气的最佳时刻是。
-
(3)
实验室用石灰石固体与稀盐酸常温下制取二氧化碳,则制取二氧化碳应选择的发生装置是,使用该装置制取气体的突出优点是。
-
(4)
常温下,氨气(NH3)是一种有刺激性气味的气体,极易溶于水,溶于水得到氨水,密度比空气小。实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,同时生成氯化钙和水,则该反应的发生装置应选。若用F装置来收集氨气,气体通入的管口是(填“a”或“b”),用F装置来收集氨气,最好后面再连接一个G装置吸收多余的氨气防止污染空气,这是因为氨气(填“极易溶于水或密度比空气小)。
四、计算题<strong><span>(</span></strong><strong><span>本题包括</span></strong><strong><span>3</span></strong><strong><span>小题,共</span></strong><strong><span>10</span></strong><strong><span>分</span></strong><strong><span>)</span></strong>
-
21.
乙醇的化学式为C2H5OH,请计算:
-
-
-
(3)
乙醇中氢元素的质量分数为(精确到0.1%)。
-
(4)
92g乙醇中碳元素的质量与g葡萄糖(C6H12O6)中碳元素质量相等。
-
22.
某原子的相对质量为23,原子核内有12个中子,请写出该元素的名称并画出该原子的结构示意图。
-
23.
某原子的实际质量为2.657×10-26kg,而一个碳原子的实际质量为1.993×10-26kg,计算该原子的相对原子质量(计算结果保留整数)。如果该原子的核内质子数等于中子数,请画出该元素的离子结构示意图。
