t/s | 0 | 50 | 150 | 250 | 350 |
0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
提出假设:稀释CH3COOH溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验:
用浓度均为的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定
, 记录数据(表格中CH3COOH和CH3COONa分别用HAc和NaAc表示)。
序号 | |||||
Ⅰ | 40.00 | / | / | 0 | |
Ⅱ | 4.00 | / | 36.00 | 0 | |
… | |||||
Ⅶ | 4.00 | a | 33.00 | 3:4 | |
Ⅷ | 4.00 | 4.00 | b | 1:1 |
①根据表中信息,补充数据:a=,b=。
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡(填“正”或“逆”)向移动。
③由实验Ⅱ-Ⅷ可知,增大浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
实验装置:

室温/℃ | 20.0 | 20.0 | 20.0 |
ΔT/℃ | 0.70 | 0.69 | 0.71 |
实验步骤:
在装有温度计和仪器X的烧杯中先加入已恒定为室温的0.1 mol⋅L-1 NaOH溶液100mL,使用仪器X搅拌,待温度计数字稳定读数后,迅速加入0.1 mol⋅L-1 CH3COOH溶液100mL。密切关注温度变化,将最高温度记为反应后体系的温度,计算出溶液上升的温度ΔT。重复上述操作3次,记录实验数据如上表所示:
已知:反应Ⅰ.
反应Ⅱ.
本实验条件下,混合溶液的密度和比热容分别按照1 g/mL和进行计算。
回答下列问题:
①本实验重复进行三次的目的为。
②由题给数据计算可知反应Ⅰ的。
③反应的热效应
(用符号ΔH1和ΔH2表示)
。
请回答下列问题:
以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7K2Cr2O7(填“>”“<”或“=”)。
(ⅰ)
(ⅱ)

①下列有关K2Cr2O7溶液的说法正确的有。
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时与
的比值保持不变
②在0.10 mol⋅L-1 K2Cr2O7溶液中设、
、
的平衡浓度分别为x、y、z mol·L-1 , 则x、y、z之间的关系式为=0.10。
③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长()取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
的
最接近的是;溶液pH从a变到b的过程中,
的值(填“增大”“减小”或“不变”)。
在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色(填“变深”、“变浅”或“不变”),一段时间后气体颜色(填“变深”、“变浅”或“不变”),但仍比拉动活塞之前针筒内气体的颜色(填“深”或“浅”)。在此过程中,该反应的化学平衡常数(填“增大”、“减小”或“不变”),混合气体中NO2的百分含量(填“增大”、“减小”或“不变”)。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为。
③图像中C、E两点气体平均摩尔质量较大的点为(填代号)。
②673K时,合成氨反应机理中各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
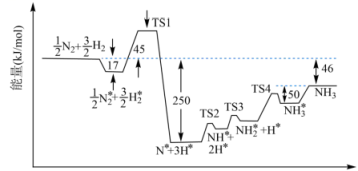
图中决速步骤的反应方程式为。
①
②
写出NH3还原NO至N2和水蒸气的热化学方程式。
。已知该反应的正、逆反应速率方程分别为
、
, 其中
、
分别为正、逆反应速率常数,变化曲线如左下图所示,则该反应的反应热
O(填“>”、“<”或“=”),写出推理过程
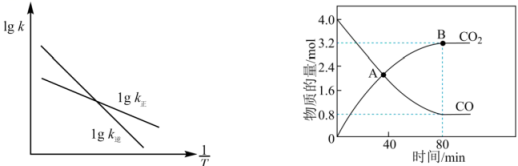
①在A点时,N2O的生成速率N2的生成速率(填“>”、“<”或“=”)。
②若平衡时总压强为p kPa,用平衡分压代替其平衡浓度表示的化学平衡常数(平衡分压=总压×物质的量分数)。