如CO2可与H2生成CH4:CO2(g)+4H2(g)CH4(g)+2H2O(g)。

下列说法错误的是____。(单选)


①、②与过渡态三种物质中,最不稳定的是;①转化为②过程中(选填“吸收”或“放出”)能量。
CO2 (g) + 3H2(g)CH3OH(g) + H2O (g)

若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率 ʋ =。
①CO2 (g) +H2(g) CO(g) + H2O (g) ②CO(g) +2H2(g)
CH3OH(g)
上述反应过程中能量变化可用如图表示,

其中反应为慢反应(填“①”或“②”)。对反应②自发性的判断正确的是(单选),判断依据是。
A.高温下自发 B.低温下自发 C.始终自发 D.始终不自发
我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附发生的化学方程式为。
以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2 , 从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是变化(填“物理”或“化学”)
利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。
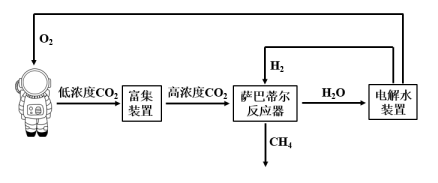
下列说法错误的是____。(双选)
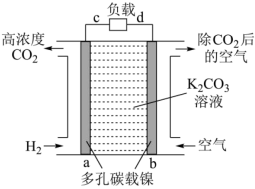
b极为极(填“正”或“负”,),a电极上发生的电极反应。

已知:(NH4)2CO3(aq)+CO2(aq)+H2O(l) 2NH4HCO3(aq) ΔH=-25.3 kJ·mol-1
吸收CO2时宜选用 (选填“低温”或“高温”)理由 、(列举两点)。
弱电解质 | H2CO3 | NH3·H2O |
电离平衡 常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
试结合必要的化学用语与简单计算,判断0.1 mol·L-1NH4HCO3溶液的酸碱性

已知:
i.能与FeCl3(aq)发生显色反应;
ii.碱性水解后酸化,所得两种产物分子均只有2种不同化学环境的氢原子。
 的合成路线补充完整。(无机试剂和有机溶剂任用)
的合成路线补充完整。(无机试剂和有机溶剂任用)
![]()
下面是利用钯催化的交叉偶联反应,以烃A与苯为原料合成某个复杂分子L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
已知:

反应①,反应⑤;
C → D:;
F→ G: 。
①能发生水解反应 ②分子中只含有两个甲基 ③不含环状结构
 写出以CH3CH2OH为原料制备CH3CH=CHCOOH的合成路线流程图(其他无机试剂和条件任选)。
写出以CH3CH2OH为原料制备CH3CH=CHCOOH的合成路线流程图(其他无机试剂和条件任选)。