结合过程1、2,写出该反应的化学方程式:。

①金属失去电子后形成(填“阴”或“阳”)离子,所以常被用作电池材料。
②研究表明,半径越大的离子越容易在电池正、负极之间移动,充电速度越快。根据图2所示锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电时间最短的是电池。
③目前,锂电池使用最广泛,但钠电池具有广阔的应用前景,尽管钠电池的能量密度不如锂电池,但钠电池的优势明显,除了充电时间较短外,结合图3分析其另一个优势是。

a.紫色石蕊试液 b.无色酚酞试液 c.溶液


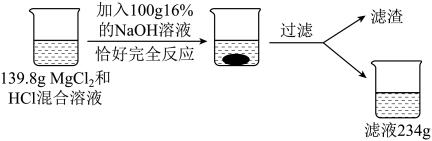
猜想二:氯化镁和。
同学们为验证猜想,设计并进行了如下实验:
|
实验操作 |
实验现象 |
实验结论 |
|
取少量该溶液于试管中,逐滴加入氢氧化钠溶液 |
|
猜想二成立 |