


下列说法错误的是
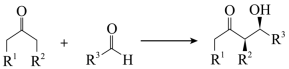 B . 1→2为消去反应,2→3为加成反应
C . 化合物3和4互为同分异构体
D . 中间体3中存在氢键
B . 1→2为消去反应,2→3为加成反应
C . 化合物3和4互为同分异构体
D . 中间体3中存在氢键
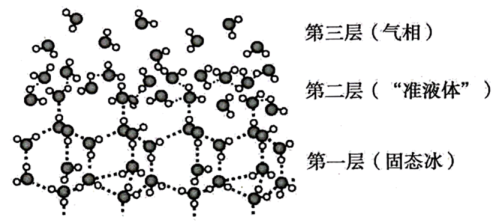



物质及其编号 | 分子式 | 沸点/℃ | 水溶性 | |
① | 甘油 | C3H8O3 | 259 | |
② | 1.2-丙二醉 | C3H8O2 | 188 | 与水以任意比混溶 |
③ | 乙醇 | C2H6O | 197.3 | |
④ | 丙烷 | C3H8 | -42.1 | 难溶于水 |

 C . 基态氧原子价电子排布图:
C . 基态氧原子价电子排布图: 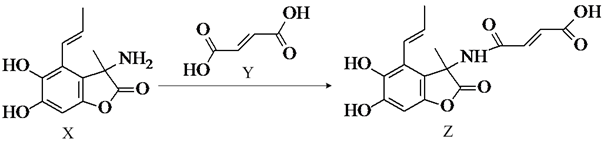
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示, 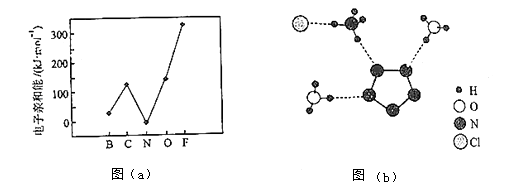
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是.
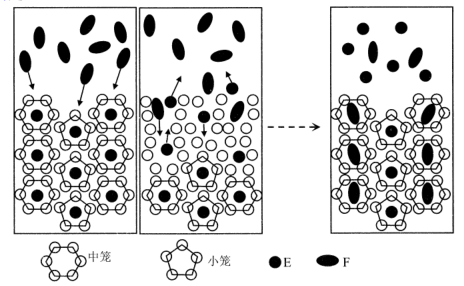
①从结构角度分析,R中两种阳离子的相同之处为,不同之处为.(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为.
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、.


①La与N间的最短距离为nm,与La紧邻的N个数为。
②在LaWN3晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于位置,N处于位置。
③设LaWN3的式量为Mr , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算表达式)。
物质及其氢健 | HF(s):F—H…F | H2O(s):O—H…O | NH3(s):N—H…N |
健能/(kJ·mol-1) | 28.1 | 18.8 | 5.4 |

H2O、HF、NH3沸点依次降低的原因是。
物质 | GaF3 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 1000 | 78 | 124 | 213 |
各物质的熔点从GaCl3、GaBr3、GaI3到GaF3依次升高,原因是。
①ClO4-的空间构型为。
②CTCN的化学式为 ,与Co3+形成配位键的原子是。(已知CO32−的结构式为
![]() )
)
③ 可以
![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为,
![]() 中含有σ键的物质的量为。
中含有σ键的物质的量为。
④ 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为。



①P4S3中硫原子的杂化轨道类型为。
②电负性: 磷硫(填“>”或“<”);第一电离能磷大于硫的原因是。

①乙醇分子中C 原子的轨道杂化类型为,NH3与H+以配位键形成NH4+ , 则NH4+的空间构型为。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有。
③NH3极易溶于水的原因主要有两个,一是,二是。



①的空间构型是,
中O原子的杂化方式是。
②中的σ键总数为个,图中a处的氢键可表示为
, 请照此画出b处的氢键。
 ),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答:
),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答:

①高氯酸镁的作用是。
②吸收管做成细长型的目的是。
③设计准确测定体积的实验方案。
 )。
)。①三聚氰酸中的C、N、O元素的第一电离能由大到小的顺序是。
②三聚氰酸分子中最多个原子共平面,三聚氰胺与三聚氰酸之间会通过(写出结构表达式)结合,在肾脏内形成结石。

三分子缩合时,还可成环。已知发生缩合反应失去
, 生成二聚物和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算各缩合产物的物质的量之比。


①该分子中与氮原子相连的氧原子的杂化轨道类型为。
②关于W的说法正确的是。
a.能发生取代、加成、还原反应
b.可与碳酸钠反应产生气体
c.含有氨基官能团

①解释氢键形成的原因。
②氢键对Q在水中溶解性的影响是(填“增大”或“减小”)。
③Cu2+与氮原子之间形成的化学键的类型是。
②B的基态原子电子的空间运动状态有种。
③C的基态原子核外电子排布式为。
④D的基态原子价层电子排布图为。

①写出与Na3NO4的阴离子互为等电子体的一种阴离子:(填化学式)。
②在573K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4 , Na2O的立方晶胞如图所示。Na2O晶胞的参数为a pm,则晶胞密度为g/cm3(列出计算式即可,NA为阿伏加德罗常数的值)。


则1mol胆矾有个氢键,写出能反映胆矾结构示意图形式的化学式。
|
元素 |
A |
B |
C |
|
结构信息 |
基态原子核外有两个电子层,最外层有3个未成对电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |

在以上分子中,中心原子采用sp3杂化形成化学键是(填写序号);在②的分子中有个σ键和个π键