
①  (g)
(g)
 (g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
(g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
②2 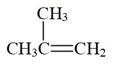 (g)
(g)
 (g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
(g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
下列说法错误的是( )

| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近X | 产生白烟 | X一定是浓盐酸 |
| B | 向 | 溶液变红 | |
| C | 将浓硫酸加入蔗糖中,产生的气体通入品红溶液 | 品红溶液褪色 | 浓硫酸具有强氧化性 |
| D | 将石蜡油蒸气通过炽热的碎瓷片分解,得到的气体通入溴的四氯化碳溶液 | 溴的四氯化碳溶液褪色 | 分解产物中一定含有乙烯 |

CH4(g)+CO2(g) 2H2(g)+2CO(g) ∆H=+247.1 kJ·mol-1
H2(g)+CO2(g) H2O(g)+CO(g) ∆H=+41.2kJ·mol-1
恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )


已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。

①三颈烧瓶中加入香菇样品和
水;锥形瓶中加入
水、
淀粉溶液,并预加
的碘标准溶液,搅拌。
②以流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液。
③做空白实验,消耗了碘标准溶液。
④用适量替代香菇样品,重复上述步骤,测得
的平均回收率为95%。
已知: ,
回答下列问题:
回答下列问题:
i.CO (g) +3H2(g) CH4(g)+H2O(g) △H1= - 206 kJ·mol-1
ii.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) △H2
iii.CO2(g) +H2(g) CO(g) + H2O(g) △H3= + 41 kJ ·mol-1
①△H2 =kJ·mol-1;
②采用“CO选择性甲烷化”的方法消除CO,该方法最明显的缺点是。
③欲使CO体积分数必须低于10 ×10-4% ,应采取的措施是(填标号)。
A.升高温度 B.降低压强 C.使用CO加氢催化剂 D.使用CO2加氢抑制剂
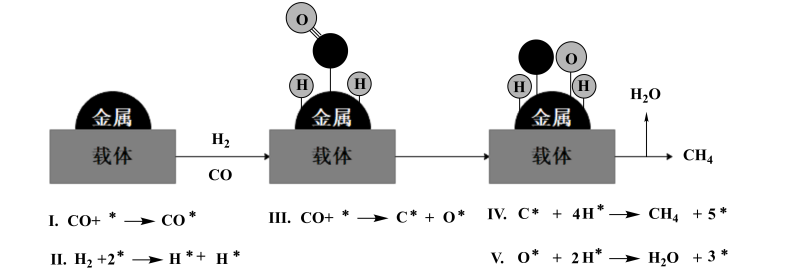
在某一条件下进行CO加氢甲烷化,发生i、ii和iii反应,相关数据如下:
体积/L | CO | CO2 | H2 | H2O | CH4 |
反应前 | 10 | 10 | 80 | 1.0 ×10-7 | 1.0 ×10-7 |
反应后 | 1.0 ×10-6 | 10 | x | 10 | 10 |
①x=(保留2位有效数字);
②此条件下反应iii的平衡常数K= 100,通过计算判断反应iii是否平衡。
已知:①N2(g)+ 2O2(g2NO2(g) ΔH1= +66.36 kJ·mol-1
②N2(g)+ 2O2 (g) N2O4(g) ΔH2= +9.16 kJ·mol-1
③N2O4(g) 2NO2
请回答:
①该反应在 下自发进行(填“高温”、“低温”、“任意温度”)。
②设v(N2O4) = k1c(N2O4), v(NO2) = k2c2(NO2), k1、k2为与温度相关的常数。在295K和315K条件下,v(N2O4)、v(NO2)与t关系如图所示。315K时,代表v(N2O4)的曲线是 (用“a”、 “b”、“c”、“d”表示),可能处于平衡状态的是 (用“A”、 “B”、“C”、“D”表示)

③在295K温度下,将一定量的气体充入一个带活塞的特制容器,通过活塞移动使体系达到平衡时总压恒为0.6 kPa.Kp(295K) =0.100,则该温度下体系达平衡时NO2的分压为
④与体系在恒容条件下温度从295K 升至315K的变化相比,恒压下体系温度升高,下列说法正确的是
A.平衡移动程度更大 B.平衡移动程度更小
C.平衡移动程度不变 D.三者均有可能

①NO2NO+ O
②
③
资料:i.次氯酸钠不稳定:a. b.
ii.将次氯酸盐转化为次氯酸能更好地发挥消毒功能,次氯酸具有更强的氧化性

[制备]
①生成的反应包括:
、
、。
②测所得溶液 , 试纸先变蓝(
)后褪色,说明溶液具有的性质是。

推测浓度在
为3或13时较小的原因:
Ⅰ.时,阳极有
放电
Ⅱ.时,
的溶解度减小
Ⅲ.时,
浓度增大,促使
被氧化
①检验电解产物,推测Ⅰ成立。需要检验的物质是。
②根据化学平衡移动原理,推测Ⅱ合理。依据的化学平衡是。
③经检验,推测Ⅲ合理。用方程式解释:。
根据上述实验,电解法制备溶液,初始
不宜过小或过大。
[保存]
低温保存、加入、
等物质能增强溶液的稳定性。
[测量]
①用硫酸和可溶解软锰矿,请补全该反应的离子方程式:
□+□ +□ =□
+□
□
②浸出时可用代替硫酸和
。下列说法正确的是(填序号)。
a.在反应中作氧化剂
b.用浸出可减少酸的使用
c.该法可同时处理烟气中的 , 减少大气污染
①软锰矿浸出液中的、
可通过加碱转化为沉淀去除,分离出清液的方法是。
②为减少碱用量,可以通过稀释浸出液除去 , 结合离子方程式解释原理:。
在一定空气流速下,相同时间内热解产物中不同价态
的占比随热解温度的变化如图。
热解过程中涉及如下化学反应:
i.
ii.
iii.

①为了增大产物中的占比,可以采用的措施是(答出两条)。
②温度升高,产物中的占比降低,可能的原因是。
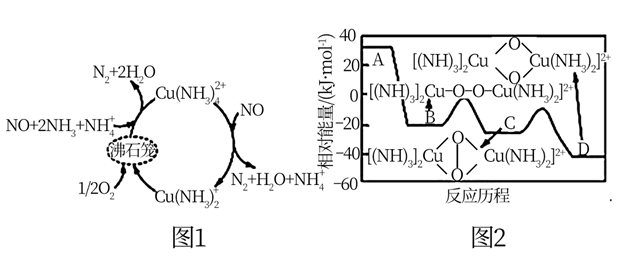
①由A到B的变化过程可表示为。
②已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-907.28kJ·mol-1
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H2=-1269.02kJ·mol-1
则图1脱除NO的总反应的热化学方程式为。
③关于该催化剂的说法正确的是(填标号)。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
Ⅰ.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)△H1
Ⅱ.2NO(g)+Cl2(g) 2ClNO(g)△H2
①关于恒温恒容密闭容器中进行的反应Ⅰ和Ⅱ的下列说法中,正确的是(填标号)。
a.△H1和△H2不再变化,说明反应达到平衡状态
b.反应体系中混合气体的颜色保持不变,说明反应Ⅰ达到平衡状态
c.同等条件下,反应Ⅰ的速率远远大于反应Ⅱ,说明反应Ⅰ的活化能小,△H1<△H2
d.达平衡后,向反应体系中再通入一定量ClNO(g),NO2(g)和NO(g)的百分含量均减小
②若向2L恒容密闭容器中加入0.2molNO和0.1molCl2发生反应Ⅱ,起始总压为p。10分钟后达到平衡,用ClNO(g)表示平均反应速率v平(ClNO)=0.008mol·L-1·min-1。则NO的平衡转化率α=,该反应的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③假设反应Ⅱ的速率方程为:v=k (1-nαt)式中:k为反应速率常数,随温度t升高而增大;α为NO平衡转化率,α′为某时刻NO转化率,n为常数。在α′=0.8时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线如图所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm , t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
A.再通入一定量的CO B.降低温度
C.及时移走CH3OCH3(g) D.通入氮气

达到平衡后,增大压强,反应Ⅰ的平衡(填“向正反应方向”、“向逆反应方向”或“不”,下同)移动,反应Ⅱ的平衡移动,故工业上选择(填“高压”或“低压”)制备二甲醚。工业生产中不选择350℃的原因是。

CH4-CO2催化重整反应为:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH1= -75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2= -394 kJ·mol−1
C(s)+ O2(g)=CO(g) ΔH3= -111 kJ·mol−1
该催化重整反应的ΔH= kJ·mol−1。

①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的CH4和CO2的体积比为。
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1453 kJ·mol-1
则CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H3=。

①根据图1可判断:p1(填“>”“=”或“<”)p2。
②A点时,用分压表示的平衡常数Kp=(分压=总压×物质的量分数)。
③甲醇燃料电池因具有能量转化率高、电量大的特点而被广泛应用,甲醇KOH碱性燃料电池负极的电极反应式为。
主反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H=-206 kJ·mol-1
副反应:①2CO(g) CO2(g)+C(s) △H=-171.7 kJ·mol-1
②CH4(g) C(s)+2H2(g) △H=+73.7 kJ·mol-1

①在合成气甲烷化过程中,经常使用Ni作为甲烷化的催化剂,但Ni基催化剂对硫、砷等很敏感,极少量的硫、砷也可能导致Ni基催化剂发生而失去活性。
②在高温条件下,导致积碳的主要原因是;不同的氢碳比(即H2、CO的物质的量之比)对CO转化率的影响如图2所示。CO的转化率随着氢碳比的变化而变化的原因是。由图2、图3可知,较为适宜的氢碳比为。
反应I:C(s)+H2O(g) CO(g)+H2(g)△H1
反应II:CO(g)+H2O(g) CO2(g)+H2(g)△H2
回答下列问题:
①在该条件下,水蒸气的平衡转化率为。
②反应II的平衡常数Kp=。(用平衡体系中各组分的分压计算的平衡常数为Kp , 分压=总压×该组分体积分数)

A.H2的消耗速率是CH3OH生成速率的2倍
B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
为了提高H2的转化率,可采取的措施为(填两条即可)。
已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=。
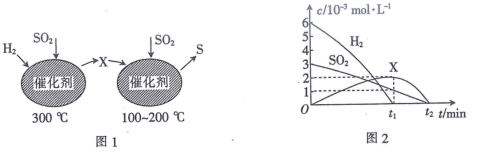
①由分析可知X为 (填化学式)。
②0~t1时间段的温度为。
①0~5min内,CO的反应速率是;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH(填“>”或“<”)0。
②T℃时,平衡常数Kp=Pa-1。
①钠硫电池是一种新型高能电池,总反应为2Na+2S Na2S2 , 该电池工作时正极的电极反应式为;给该电池充电时,钠电极应与外电源的(填“正”或“负”)极相连接。
②在碱性溶液中,S 被BrO
氧化成SO
,BrO
被还原成Br-。该反应的离子方程式是。
则氧再生反应的
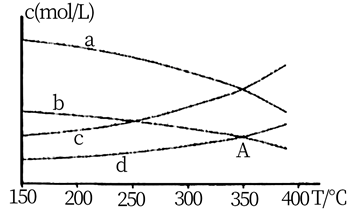
①若 ,则曲线代表CH4。
②350℃时,A点的平衡常数为 (填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。
③关于以上反应,下列说法正确的是(填字母)。
a.CH4和CO2浓度相等时可判断反应到达平衡状态
b.消耗1 mol CO2同时断裂4 mol C-H键可判断反应到达平衡状态
c.平衡后,按起始原料比再充入反应物,维持温度不变,再次达平衡时,甲烷的体积分数不变
d.若体系改为恒温恒容,反应物起始投料比不变,CO2的平衡转化率减小

①光催化CO2转化为CH4的阴极方程式为。
②催化剂的催化效率和CH4的生成速随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是。
i.2CO2(g)+6H2(g) ⇌C2H4(g)+4H2O(g)△H=-127.89kJ•mol-1
ii.CO2(g)+H2(g) ⇌H2O(g)+CO(g)△H=+41.2kJ•mol-1
步骤I:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)+CO(g)△H=-49.5kJ•mol-1 , 写出步骤II由甲醇制乙烯的热化学方程式。

①400~600℃,CO2的平衡转化率随着压强的升高而增大,B点v正A点v逆(填“>”“<”或“=”)。在A点给定的温度和压强下,提高CO2平衡转化率的方法有。(任写一种)
②在恒定压强下,随着温度的升高,CO2的平衡转化率先降低后升高。试分析可能原因。
③根据图像可知,为了获得更多乙烯等低碳烯烃,反应条件应控制在(填序号)。
A.压强0.1~1.0MPa B.温度300~400℃
C.压强2.0~3.0MPa D.温度900~1000℃
一定条件下,将H2和CO2[n(H2):n(CO2)=3]以一定的流速通过K—Fe—MnO/Al2O3催化剂进行反应,测得CO2的平衡转化率为50.0%,C2H4和CO的物质的量之比为2∶1,反应i的化学平衡常数Kp=(只列算式不计算)。不改变气体流速和温度,一定能提高C2H4选择性的措施有。(任写二种)
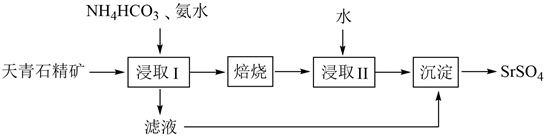
①写出生成SrS的化学反应方程式:。
②设计以黑灰为原料,制取SrSO4的实验方案:。
(已知:SrS易溶于水,易水解。水浸时的浸取率随温度变化如下图。实验中锶元素需充分转化SrSO4 , 必须使用的试剂:蒸馏水、3mol·L-1H2SO4和NaOH溶液)。
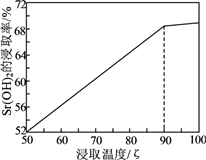
相关化学键的键能如下表所示:
|
化学键 |
Cl—Cl |
N | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=mol·L-1·min-1;当升高温度,该反应的平衡常数K(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是 (填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=[已知:气体分压(P分)=气体总压(Pa)×体积分数]
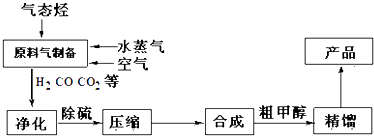
另有副反应:2CO+2H2O═CO2+CH4 等;中压法操作:压力为10﹣15MPa,温度控制在513K﹣543K,所用催化剂是CuO﹣ZnO﹣Al2O3 . 合成甲醇的流程如图所示,
请回答: