选项 | 探究方案 | 探究目的 |
A | 向试管中滴入几滴1-溴丁烷,再加入2mL5%NaOH溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴2%AgNO3溶液,观察现象 | 检验1-溴丁烷中的溴元素 |
B | 向盛有4mL0.1mol•L-1KBr溶液的试管中加入1mL新制氯水,振荡,观察溶液颜色变化 | Cl2的氧化性比Br2强 |
C | 室温下,比较等物质的量浓度的NaF溶液和NaClO溶液pH的相对大小 | Ka(HF)>Ka(HClO) |
D | 向盛有5mL0.005mol•L-1FeCl3溶液的试管中加入5mL0.015mol•L-1KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化 | 反应物浓度影响化学平衡 |
反应I:ClCH2CH2Cl(g)→HCl(g)+CH2=CHCl(g) ΔH1=+69.7 kJ•mol-1
反应Ⅱ:HC≡CH(g)+HCl(g)→CH2=CHCl(g) ΔH2=-98.8 kJ•mol-1
1.0×105Pa下,分别用如表三种方式进行投料,不同温度下反应达到平衡时相关数据如图所示。|
方式 |
气体投料 |
平衡时相关数据 |
|
甲 |
ClCH2CH2Cl |
ClCH2CH2Cl转化率 |
|
乙 |
n(HC≡CH):n(HCl)=1:1 |
HC≡CH转化率 |
|
丙 |
n(ClCH2CH2Cl):n(HC≡CH)=1:1 |
CH2=CHCl产率 |

下列说法错误的是





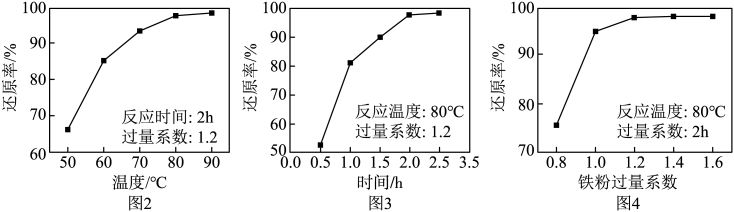
设计由100mL“滤液”[其中c(Fe3+)=0.8mol•L-1]制备硫酸亚铁粗品的实验方案:。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
C6H5C2H5(g)C6H5CH=CH2(g)+H2(g) ΔH=akJ•mol-1
保持气体总压不变,原料气按以下A、B、C三种投料方式进行:
A.乙苯
B.n(乙苯):n(N2)=1:10
C.n(乙苯):n(CO2)=1:10
三种投料分别达到平衡时,乙苯转化为苯乙烯的转化率[×100%]与温度的关系如图1所示。

①α0(填“>”、“<”或“不能确定”)。
②相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是。
③相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是。
④工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2 , 可较长时间内保持催化剂的催化活性,其原因是。
①在催化剂X作用下,CO2参与反应的机理如图2所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。根据元素电负性的变化规律,图2所示的反应机理中步骤I和步骤II可描述为。

②保持混合气体总压(p)等其他条件不变,CO2的分压[p(CO2)=×p]与乙苯转化率的关系如图3所示。p(CO2)>14kPa时,乙苯转化率下降的原因是。
