目的 | 方案设计 | 现象和结论 | |
A | 比较镁与铝元素的金属性强弱 | 取 | 观察到氯化镁溶液出现白色沉淀,氯化铝溶液先出现白色沉淀后溶解。证明镁的金属性更强 |
B | 检验溶液中是否含有 | 取少量溶液于试管中,先滴加 | 先产生白色沉淀,再加稀盐酸,沉淀不溶解,则说明溶液中一定含有 |
C | 探究氢离子浓度对 | 向 | 溶液由黄色变为橙色,则说明增大氢离子浓度,转化平衡向生成 |
D | 检验溶液中是否含有 | 向盛有少量待测液的试管里滴加2滴KSCN溶液,观察现象 | 试管中溶液出现血红色,证明溶液中含有 |
编号 | 时间/min 浓度/(mol/L) 催化剂种类 | 0 | 50 | 100 | 150 | 200 | 250 |
1 | 催化剂I | 3.00 | 2.40 | 1.80 | 1.20 | 0.60 | 0 |
2 | 催化剂II | 3.00 | 1.80 | 0.60 | 0 | 0 | 0 |
3 | 催化剂III | 1.50 | 0.90 | 0.30 | 0 | 0 | 0 |
| 温度(℃) | 15 | 20 | 25 | 30 | 35 |
| 平衡时气体总浓度(×10-3mol·L-1) | 2.40 | 3.40 | 4.80 | 6.80 | 9.40 |
下列说法正确的是( )
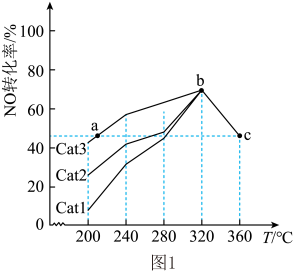
其他条件相同,催化效率最高的是(填“Cat1”“Cat2”或“Cat3”)。在a、b、c点中,达到平衡状态的是(填代号)。
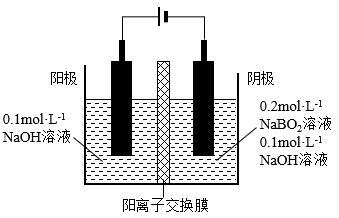
①电解池阴极的电极反应式为。
②两电极区间使用阳离子交换膜,不允许阴离子通过的原因是。
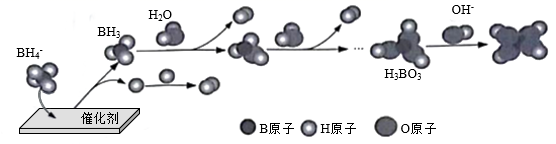
①其他条件不变时,以 代替
催化释氢,所得气体的分子式为。
②已知: 为一元弱酸,
水溶液呈酸性的原因是(用离子方式表示)。

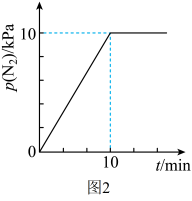
①0~20min内,温度随时间快速升高的原因是。
②20min后,氢气体积在增加,而温度却下降的原因是。

已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取 , 萃取时发生反应:
, 生成的
可溶解在HR中。②
,
的溶解度如图1所示:



已知:H2O、HX等杂质易使Ni催化剂中毒。回答下列问题:
