
常温时,部分金属离子开始沉淀及沉淀完全的如下表所示(浓度
时可认为金属离子沉淀完全):
沉淀 | ||||
开始沉淀时的 | ||||
恰好完全沉淀时的 |
①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为。
②若将草酸钠换成草酸铵溶液,则不同的混合方式均不会生成杂质沉淀,原因是。

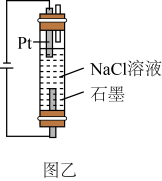
①图乙装置中所发生总反应的化学方程式为。
②与图甲所示方法相比,图乙所示方法的优点除装置简单外,还有:。
已知:酸性条件下与
和
反应的离子方程式如下:
①加入的目的是除去
, 已知
反应后生成
, 写出该反应的化学方程式:。
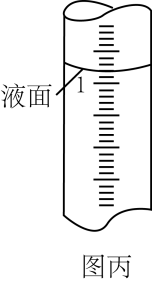
②滴定过程中,滴定管中液面如图丙所示。此时读数为。
③滴定终点的实验现象是。
④计算样品中的质量分数(写出计算过程)。
①部分物质的能量大小如图所示。

则的
。
②已知键能 ,
, 则
。
③ , 维持温度和压强不变,向反应体系中充入大量水蒸气(不参与反应),目的是。

①图中A点反应一定未达平衡,原因是。
②若C点反应也未达平衡,可能的原因是。