|
|
|
|
A.外加电流 | B.牺牲阳极 | C.表面镀铜 | D.制成不锈钢 |
t/min | 0 | 10 | 20 | 30 | … | 80 | 90 |
c(N2O5)/(mol·L−1) | 1.40 | 0.96 | 0.66 | 0.45 | … | 0.11 | 0.11 |
下列说法错误的是( )

① ②
③HCOOH ④


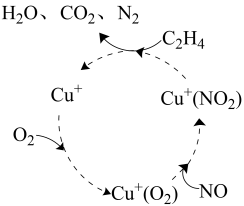
①若反应过程放出热量为32.54 kJ,则除去的NO物质的量为。
②不考虑催化剂因素,催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是。

过程Ⅰ、Ⅱ典型的人工光合作用过程: , 该反应是反应 (填“吸热”或“放热)。
主反应:
副反应:
①CO、生成
的热化学方程式是。
②一定条件下,向体积为V L的恒容密闭容器中通入1 mol 和3 mol
发生上述反应,达到平衡时,容器中
为a mol,CO为b mol,此时
的浓度为
(用含a、b、V的代数式表示)。
③为提高在单位时间的产率,可采取措施:(写出一条即可)。

曲线b条件下投料比改变,则x1(填“>”、“<”或“=”);反应从开始分别进行到M、M1、N三点时,放出热量为
、
、
, 其由大到小的顺序为。

实验序号 | A溶液 | B溶液 |
① | 20 mL | 30 mL |
② | 20 mL | 30 mL |