图像中和
的关系是:
(填“>”“<”“=”或“无法确定”)。
的电离方程式为。
I.
II.
①列说法正确的是。
A.平衡时向容器中充入情性气体,反应I的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
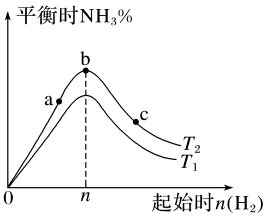
C.平衡时的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,的转化率为70%,
的物质的量为
。此时,整个体系(填“吸收”或“放出”)热量kJ,反应I的平衡常数
(以分压表示,分压=总压×物质的量分数,保留两位有效数字)。

①某温度下,吸收塔中溶液吸收一定量的
后,
, 则该溶液的
(该温度下
的
,
)。
②吸收塔中被吸收的离子方程式为。
③利用电化学原理,将电催化还原为
, 同时阳极得到氧气,阳极反应式为。
I.取已知浓度的溶液,搅拌下滴加足量
溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
II.向草酸溶液中加入适量
固体,制得
和
混合溶液。
III.将II的混合溶液加热至80~85℃,加入I中的黑色沉淀。全部溶解后,趁热过滤。
IV.将III的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(II)酸钾晶体,进行表征和分析。
回答下列问题: