①医用口罩的中间层是用来隔离病毒的熔喷布。口罩隔离病毒相当于化学实验操作中的(填实验操作名称)。
②下图是某品牌医用口罩的外观及外剖面图,标识的部件所使用的材料有(填序号)。
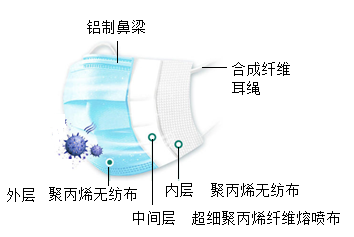
A.天然有机高分子材料 B.金属材料 C.合成材料
③口罩鼻梁上的金属条通常采用铝条,铝条耐腐蚀的原因是(用化学方程式表示)。


Ⅰ、转化①的基本反应类型属于反应。
Ⅱ、物质A是常见的碱,写出A的化学式:。
Ⅲ、反应④发生的现象为。
Ⅳ、转化⑤的反应在医疗上可用来治疗。
Ⅴ、写出转化⑥反应的化学方程式:。
小红同学认为反应③既可利用“酸和碱”反应,也可利用“碱和盐”反应生成NaCl,请写出一个“碱和盐”反应的化学方程式。

①用到的金属材料有(答一条即可);
②汽车轮毂材料用铝合金而不用纯铝,其主要原因是;
③车身喷漆除保持汽车美观外,其主要作用是。
①如果滤液呈无色,则滤渣中一定含有的金属是;
②如果滤液中加入稀盐酸有白色沉淀,则滤液中的金属阳离子有种;
③如果滤液呈浅绿色,则关于该滤渣和滤液的下列说法中正确的是(填序号)。
A.向滤渣中加入稀盐酸,一定有气泡产生
B.向滤液中加入稀盐酸,一定有白色沉淀产生
C.滤渣中一定含有Ag
D.滤液中一定含有Fe(NO3)2 , 一定不含AgNO3 , 可能含有Zn(NO3)2


试管编号 | ① | ② | ③ | ④ |
试管内试剂 | NaOH 溶液 | MgCl2溶液 | Na2CO3溶液 | Ba(NO3)2溶液 |
加入稀硫酸后的现象 | 无明显现象 | 无明显现象 | 产生气泡 | 白色沉淀生成 |
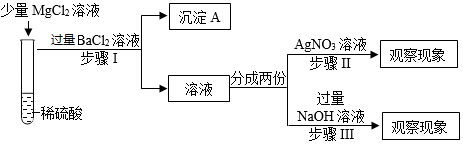
①沉淀A的化学式是。
②老师评价该方案时指出:设计思路正确,但试剂选择有误。你认为应该将步骤Ⅰ的试剂改成。小明按照修改后的方案进行了实验,最后得出试管②中没有发生复分解反应的结论,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是。
③小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是。