B .
B .  C .
C .  D .
D . 

| 序号 | 物质 | 杂质 | 可选用的试剂及操作方法 |
| 甲 | CaCO3 | KCl | ①加适量水,搅拌,过滤;②加过量稀H2SO4 , 微热,过滤;③溶解后加适量KOH溶液,过滤;④溶解后加过量Na2CO3 , 过滤,蒸发;⑤加热(或高温灼烧) |
| 乙 | NaCl | CaCl2 | |
| 丙 | Na2SO4 | CuSO4 | |
| 丁 | Cu | CuO |

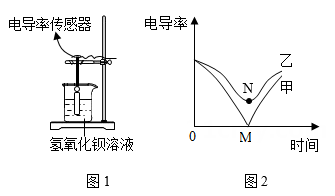
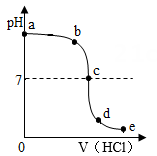
①不同酸具有相似的化学性质, 但性质也存在差异。图 1 中能体现酸的通性的是 (填字母序 号,下同);
②一杯水中氢元素与氧元素的质量比和 1 个水分子中氢原子与氧原子的质量比(填“相等” 或“不相等”)。


① 图 2 圆圈中表示这杯氯化钠溶液的构成, 则该氯化钠溶液中溶质和溶剂的质量比是;
②通过分析组成和结构,可以预测物质的某些性质。根据图 3 硫酸氢钠溶液的微观图示,分析推测 NaHSO4 的性质,其中合理的是
A.其水溶液能导电 B.其水溶液能使紫色石蕊试液变红
C.其水溶液能与金属锌反应生成氢气 D.其水溶液与硝酸钡溶液反应生成硫酸钡沉淀。
①Ag、FeCl2溶液、AlCl3溶液 ② Fe、AlCl3溶液、AgNO3溶液 ③ Ag、Fe、AlCl3溶液
①取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液
②取少量浸出液于试管中,为排除CO32-和SO42-对检验Cl-的干扰,该同学向试管中加入足量的一种某盐溶液
③将上述溶液过滤,取滤液于另一支试管中,加入少量硝酸银溶液和稀硝酸回答下列问题:
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口液化成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有性,可能实验中使用的盐酸浓度过高,试管口就会形 成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸,证明猜想二是 合理的。
Ⅱ. 小柯提出质疑:为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白 雾?
小柯联系反应时试管外壁很烫, 于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后 (填操作), 将(选填“干燥的”、“湿润的”) 蓝色石蕊试纸放在试管口,试纸变红。
得出结论: 这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
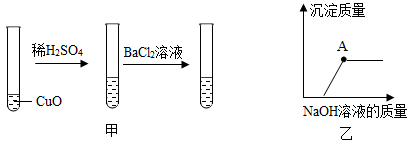
某小组同学用下图所示装置制取硫酸铜。请回答以下问题:

实验1:用pH试纸测试滤液pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填“实验 1”或“实验 2”)
实验1:将一定质量的镁条、铁粉和氯化钠加入盛有适量水的隔热容器中,连续搅拌,每隔一段时间记录一次温度,在图甲上绘得曲线1;然后把相同质量的镁条剪成若干细条,重复上述实验,绘得曲线2;再取相同质量的镁粉重复上述实验,绘得曲线3。
实验2:把2.4g镁粉、5.85g氯化钠和一定质量的铁粉混合,放入盛有100mL水的隔热容器中,并不断搅拌,一段时间后测出容器内的温度。图乙是在改变铁粉质量的实验条件下,绘得的温度变化曲线。
实验3:把2.4g镁粉、28g铁粉和一定质量的氯化钠混合,放入盛有100mL水的隔热容器中,并不断搅拌,一段时间后测出容器内的温度。图丙是在改变氯化钠质量的实验条件下,绘得的温度变化曲线。