[实验步骤]
a.迅速称取烧碱样品1.2 g,溶解后配制成250 mL溶液,备用:
b.将0.1000 mo/L HCl标准溶液装入酸式滴定管,调零,记录起始读数;
c.用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和),记录酸式滴定管的读数
;
d.然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数。
滴定至第一终点的过程中,发生反应的离子方程式为。
a.滴定前有气泡,滴定至第一终点时气泡消失
b.达到第一终点前,锥形瓶中有气泡产生
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
d.记录酸式滴定管读数时,仰视标准液液面
第一步,称量m g样品于锥形瓶中,溶解后加稀酸化,用
mol/L
溶液滴定至终点,消耗
溶液
mL。
第二步,向上述溶液中加入过量锌粉将转化为
, 过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀
酸化,用
mol/L
溶液滴定至终点,消耗
溶液
mL。
该晶体中铁的质量分数的表达式是。
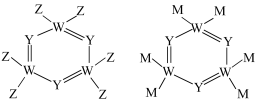
a. b.
c.
d.
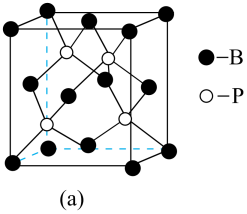
①在BP晶胞中健角为。
②磷化硼(BP)晶体中“一般共价键”与配位健的数目之比为。
③根据图(a),图(b)中矩形是沿晶胞对角面取得的截图。晶胞中各原子在矩形
的位置为(填标号)。

A. B.
B.
C. D.
D.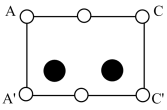
④若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA , 晶体的密度为(列出计算表达式,不要化简)。

A.
B.
C.
D.
E.

则阴极的电极反应式为。假如通电前a、b两室溶液的质量相等,若有NA个通过交换膜,则两室溶液的质量差为g。

①电极a上发生反应的电极反应式为。
②理论上1 mol H2S参加反应可产生H2的物质的量为。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
弱酸 | HClO | H2CO3 | H2SO3 |
电离平衡常数(25℃) |
|
|
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是(填化学式)
②将浓度均为0.1 mo/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是。
③根据表内数据,计算0.06 mol/L Na2SO3溶液的pH=(忽略的第二步水解)。
④测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。
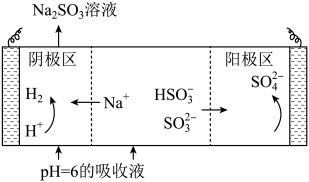
电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是。