①该反应的生成物总能量(填“大于”“小于”或“等于”)反应物总能量。
②氢气的燃烧热为。
③该反应的热化学方程式为。
④若1molH2完全燃烧生成1mol气态水放出241kJ的热量,已知H-O的键能为463kJ·mol-1 , H-H的键能为436kJ·mol-1 , 计算O=O的键能为kJ·mol-1。
Mg(s)+H2(g)=MgH2(s) △H1=-72.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1;
MgNi2(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=kJ·mol-1。
2CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
已知△G=△H-T△S,反应CO(g)+2H2(g)CH3OH(g)的△G随温度的变化是图1中的(填“L1”或“L2”)。

①一定温度下,假设正逆反应速率与浓度关系为v正=k1c(NO2)•c(CO),v逆=k2c(CO2)•c(NO),k1、k2只与温度相关,则反应的平衡常数K=(用含k1、k2的式子表示)。
②催化剂M活性随温度变化情况如图2所示,相同时间测得NO2的转化率随反应温度变化情况如图3所示,写出T0后NO2的转化率出现如图变化的可能原因。

③在图3中画出并标注,其他条件不变,增大压强(催化剂不失活)情况下,NO2的转化率随温度变化图。
O3氧化过程中部分反应的能量变化如图所示,Ea1是反应的活化能,一定条件下,活化能越大反应速率越慢,反应越困难。

①写出SO2与O3反应的热化学方程式:。
②在相同条件下,O3与NO反应的速率O3与SO2的反应速率。(填>、=、<)
③其他条件不变时,工厂烟气处理主要发生NO与O3反应,即使增加n(O3),O3氧化SO2的反应几乎不受影响,可能原因是。
40℃时向一定量NaClO溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出5min时溶液中NO与ClO-反应生成和Cl-的离子方程式:。
②烟气中含有少量SO2 , NO的脱除率比不含SO2的烟气高,可能原因是。
共价键 | C-H | C-O | C≡O | H-H | O-H |
键能(kJ·mol-1) | 410 | 358 | 839 | 436 | 467 |
由此可估算反应CO(g)+2H2(g)CH3OH(g)的焓变△H=kJ·mol-1。
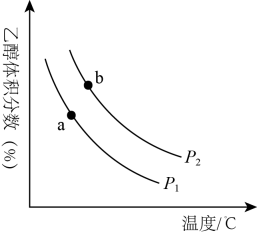
①a、b两点的平衡常数KaKb(填“>”“<”或“=”)。判断依据是。
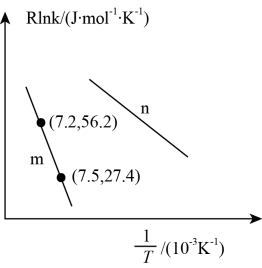
②已知Arrhenius经验公式为Rlnk=-+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得如图所示曲线。在m催化剂作用下,该反应的活化能Ea=kJ·mol-1。