
 B . 铝蒸锅
B . 铝蒸锅  C . 铁锤
C . 铁锤  D . 铜导线
D . 铜导线 
| 熔点 | 2500℃ |
| 密度 | 3g/cm3 |
| 强度 | 与钢相似 |
| 导电性 | 良好 |
| 导热性 | 良好 |
| 抗腐蚀性 | 优异 |

 B . 小气球变大
B . 小气球变大
 C . 验证Fe、Cu、Ag金属活动性强弱
C . 验证Fe、Cu、Ag金属活动性强弱
 D . U型管内液面左高右低
D . U型管内液面左高右低


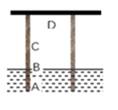
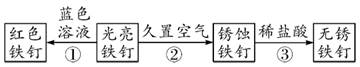
①滤液中一定有Zn2+、Fe2+ ②滤液中可能有Ag+ ③滤渣中一定有Ag,可能有Fe




|
编号 |
操作 |
现象 |
|
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象、 |
|
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
|
丙 |
将表面打磨后的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
[提出假设]
a.Al>>Cr>Cu
b.Cr>Al>Cu
c.
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中观察现象,记录如下:
|
金属 |
Cr |
Al |
Cu |
|
与盐酸反应的现象 |
气泡产生缓慢, 金属逐渐溶解 |
气泡产生激烈, 金属迅速溶解 |
无气泡产生, 金属无变化 |
[得出结论]。
原假设中正确的是假设:(填“a”“b”或“c”)。写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:。

|
实验次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
加入稀硫酸的质量(克) |
35 |
35 |
35 |
35 |
|
剩余固体的质量(克) |
8.6 |
7.4 |
6.2 |
5.2 |
|
第1次 |
第2次 |
第3次 |
第4次 |
|
|
加入稀硫酸质量(g) |
200 |
200 |
200 |
200 |
|
剩余固体质量(g) |
37.6 |
15.2 |
4 |
4 |
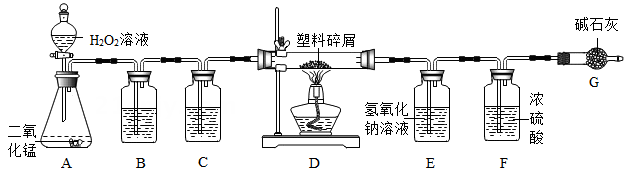
并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
