A.开发清洁能源 B.多使用化石燃料 C.提倡使用节能电器

已知:Ⅰ、粗品硫酸钠含少量H2SO4、MgSO4、CaSO4、FeSO4等杂质。
Ⅱ、在溶液里,微溶物发生复分解反应可转化为不溶物。
Ⅲ、部分物质的溶解性见表。
部分物质的溶解性表(室温)
阴离子 阳离子 | ||
Na+ | 溶 | 溶 |
Ca2+ | 微溶 | 不溶 |
Mg2+ | 溶 | 微溶 |
Fe2+ | 溶 | 不溶 |
Ⅰ、制碱石灰的流程:
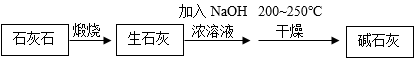
Ⅱ、Ca(OH)2的分解温度是580℃;NaOH受热不分解。
煅烧石灰石发生反应的化学方程式是。
【作出猜想】样品中的成分可能有下列几种:
猜想1:Ca(OH)2、NaOH
猜想2:CaCO3、Ca(OH)2、NaOH
猜想3:CaCO3、NaOH、Na2CO3
猜想4:CaCO3、Na2CO3
【实验探究】该小组同学设计并进行了如下实验(已知BaCl2溶液呈中性)。
|
实验步骤 |
现象 |
结论 |
|
①取5 g“碱石灰”样品于烧杯中,加入50 g水,充分搅拌后,静置 |
烧杯底部有白色固体 |
猜想1不正确 |
|
②取①烧杯中上层清液少许,加入试剂X |
无明显现象 |
猜想2不正确 |
|
③取①烧杯中上层清液少许,滴2滴酚酞溶液 |
溶液变红 |
猜想3正确,而猜想4不正确 |
|
④取③变红的溶液,加入过量BaCl2溶液 |
|
实验①方案不严密,理由是。
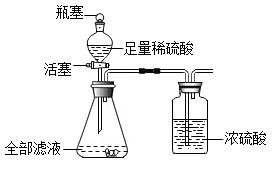
实验记录如下表。
|
滤渣质量 |
活塞关闭时整个装置总质量(仪器+药品) |
打开瓶塞和活塞反应完成后整个装置总质量(仪器+药品) |
|
8.00 g |
442.64g |
442.20g |
【结论与评价】
根据数据可计算原样品中各成分的含量,其中NaOH的质量分数是。