
①羟基与羧基中氢的活性:羟基羧基。
②
|
物质 |
钠 |
乙醇 |
冰醋酸 |
|
密度/( |
0.968 |
0.789 |
1.05 |
|
反应物 |
实验现象 |
钠完全溶解所需时间 |
|
钠与无水乙酸 |
钠,产生气泡较慢 |
|
|
钠与无水乙醇 |
钠,产生气泡较快 |
|
【实验结论】钠与无水乙醇反应的反应速率比钠与无水乙酸反应的反应速率快得多。
①金属失电子的过程:
②金属离子离开的过程:
③活性氢得电子的过程:
④分子离开的过程:
猜想原因:对照钠与水反应的反应速率的影响因素,钠与无水乙醇或无水乙酸反应的反应速率主要是由第②个因素决定的,即由生成的乙酸钠(或乙醇钠)在无水乙酸(或无水乙醇)中的决定。
一定温度下,在某恒容密闭容器中充入一定量的 和
,发生反应:
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
在 某恒容密闭容器中,充入
和
,发生反应:
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
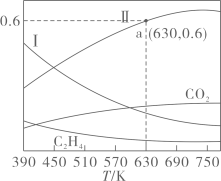
①该反应的 (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示(填化学式,下同)和的变化曲线。
②根据图中a点,计算该温度下平衡时的
,
,
的平衡转化率为
(保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数
(列出计算式,用分压表示,分压
总压
物质的量分数)。