
P4(白磷,s)+5O2(g)=P4O10(s) △H1=-2983.2kJ•mol-1
P(红磷,s)+O2(g)=
P4O10(s) △H2=-738.5kJ•mol-1
则该温度下,白磷转化为红磷的热化学方程式为。
①增加C的物质的量②定容密闭容器中继续充入NO③在反应器中加入NaOH溶液④升高反应温度⑤缩小容器体积
时间/min 浓度/(mol•L-1) 物质 | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
①10~20min内,N2的平均反应速率v(N2)=。
②在30min时向容器中加入合适催化剂,v(正),v(逆)。(填“增大”“减小”或“不变”)

a.沿玻璃棒缓慢倒入
b.分三次少量倒入
c.一次迅速倒入
实验次数 | 起始温度/℃ | 终止温度/℃ | 温度差/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.63 | 3.38 |
2 | 24.5 | 24.2 | 24.35 | 27.74 | 3.39 |
3 | 25 | 24.2 | 24.75 | 28.15 | 3.40 |
表中记录的终止温度是指,根据上表数据计算中和反应的反应热△H=(近似认为实验所用盐酸和NaOH溶液的密度都是1 g•cm-3 , 中和后溶液的比热容c为4.18 J•g-1•℃-1)。
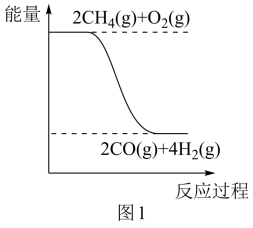
化学键 | O=O | C-H | H-H | C≡O |
键能/(kJ•mol-1) | 498.8 | 413 | 436 | 1072 |
该反应的热化学方程式为。

①能判断该反应达到化学平衡状态的是(填标号)。
a.密度不再变化
b.H2的转化率和CO的转化率相等
c.混合气体的平均相对分子质量不再改变
②比较p1p2(填“>”“<”或“=”),理由。