 B . 检查气密性
B . 检查气密性 C . 加热固体
C . 加热固体 D . 氧气验满
D . 氧气验满
补充完整步骤Ⅱ的化学方程式:。该反应前后碳元素的化合价(填“升高”、“降低”或“不变”)。
甲酸在催化剂作用下分解生成H2和CO2 , H2和CO2的分子个数比为。
已知:①相同条件下,气体的体积比等于分子个数比。
②甲酸除分解为H2和CO2外,还可能按如下方式分解:
根据甲酸分解原理,推测气体产物的成分在常温下有三种可能:H2和CO2;CO;(填化学式)。
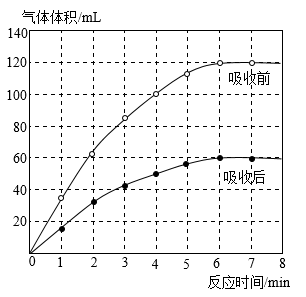
①气体通过氢氧化钠溶液后体积减小的原因是(用化学方程式表示)。
②甲酸催化分解所得气体产物的主要成分为(填化学式)。

已知:①氯化钙溶液接近中性;②CO2与NaHCO3溶液不反应。
①锥形瓶内发生反应的化学方程式为。
②由实验现象可推知CO2具有的性质:不可燃,不支持燃烧,。
①写出滤液所含溶质的化学式:。
②向上述滤液中缓慢加入(填字母),搅拌,调节溶液pH至6~9,倒入指定容器。
a、碳酸钙粉末 b、澄清石灰水 c、氢氧化钠溶液
已知:①铁黄制备原理
②为促进生成的铁黄沉淀有序生长,实验时需加入少量已制铁黄作为晶种。

步骤一:加入一定量除锈后的碎铁皮
步骤二:加入含有少量铁黄晶种的悬浊液;
步骤三:滴加少量FeSO4溶液;
步骤四:控制合适条件,边搅拌边鼓入空气,充分反应48小时,得到大量FeOOH沉淀。
①将三颈烧瓶中所得FeOOH沉淀分离出来的实验操作是(填操作名称)。
②为提高产品纯度,需洗涤分离出的沉淀。洗涤前沉淀表面吸附的阴离子为(填离子符号)。
③实验中仅滴加少量FeSO4溶液,就能得到大量FeOOH沉淀,其原因是。
生命保障系统是中国空间站实现在轨长期运行的关键,该系统包括电解制氧、水处理、二氧化碳及微量有害气体去除等子系统。
电解制氧技术是目前公认最具合理性的空间站氧气补给技术,利用太阳能电池板供电,电解1L水能产生约620L氧气,可满足1名宇航员一天的需要。水中加入氢氧化钾可提高电解水效率,随技术进步,氢氧化钾逐渐被固体电解质等替代。电解水产生的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
水处理系统主要是将水蒸气、汗液、尿液和生活废水等进行处理,其过程包括净化、低压(10kP左右)蒸馏和冷凝。经过该系统处理的水达到饮用水标准,且水的回收率达80%以上,回收的水用于宇航员生活用水和电解制氧。
碳捕集:捕捉烟气CO2 , 将其再释出可实现资源化利用,相关物质转化如下:

碳的资源化利用 中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:
![]()


①推测分子中氢原子数目:甲醇甲醛(填“>”、“<”或“=”)。
②为使甲醇持续转化为甲醛,反应b需补充H2O2.理论上需补充的H2O2与反应a中生成的H2O2的分子个数比≥。


①通空气8小时左右,所得固体几乎全部为Mn3O4.推出该结论的依据是。
②通空气超过8小时,产物中锰元素质量分数减小的原因是。
已知:①部分银盐的溶解性如下表
|
|
NO3- |
Cl- |
CO32- |
|
Ag |
溶 |
不 |
不 |
②氯化银不溶于稀硝酸。
实验Ⅰ、取纯碱样品,加水溶解得溶液X,测得溶液pH约为12。
实验Ⅱ、取溶液X,滴加过量试剂Y,产生能使澄清石灰水变浑浊的气体。
实验Ⅲ、向实验Ⅱ后所得溶液中滴加硝酸银溶液,有白色沉淀生成。
结论:样品中含有氯化钠。
①测定溶液pH的操作:用玻璃棒蘸取溶液滴在pH试纸上,与相比较。
②实验Ⅱ中所加的试剂Y应选用(填字母)。
a、稀盐酸 b、稀硝酸 c、氢氧化钠溶液 d、氯化钙溶液
③由上述实验推断,溶液X中含有的阴离子除Cl-外,还有(填离子符号)。
准确称取2.000g干燥纯碱样品,加水溶解,逐滴加入溶质质量分数为3.65%的稀盐酸,边滴加边搅拌,当两者恰好完全反应时(含碳物质全部转化为CO2),消耗盐酸体积为37.00mL。(该盐酸的密度近似等于1g·mL-1 , 杂质不与盐酸反应)
①通过计算判断该纯碱样品的等级。(写出计算过程)
无水碳酸钠等级规定如下:
|
|
优等品 |
一等品 |
合格品 |
|
碳酸钠质量分数 |
≥99.2% |
≥98.8% |
≥98.0% |
②实验发现,当滴入盐酸体积略少于37.00mL时,溶液pH就降至7以下(约为5),溶液pH小于7的原因是。将此时的溶液煮沸,pH会略有升高,其原因。