①取一定量于烧杯中溶解,分批次加入适量浓氨水,搅拌、过滤、洗涤、干燥。
②将、乙二胺四乙酸、
加入三颈烧瓶(装置如图),用
溶液调节pH,搅拌、80℃水浴反应1h,经过一系列操作,洗涤,晾干得到产品。

回答下列问题:
①指示剂为。
②计算可知,样品中的质量分数为%。
③若滴定过程较为缓慢,则测得样品中的质量分数偏大,其原因是。
请回答下列问题:

①电极a上的电极反应式为。当有7.5 g 参与反应时,理论上产生电量为C(已知法拉第常数
)
②常温下,的溶度积常数
, 通常认为溶液中某离子浓度小于
为沉淀完全,若该微生物电池工作结束后恢复至常温,测得右侧溶液的
, 请结合计算说明此时溶液中的
是否沉淀完全:。
|
共价键 |
C-H |
C-O |
|
H-H |
O-H |
|
键能( |
413 |
358 |
839 |
436 |
467 |
由此可估算反应的焓变
。

①压强(填“>”“<”或“=”,下同)。判断依据是。
②a、b两点的平衡常数。
③已知Arrhenius经验公式为(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=
。从图中信息获知催化效能较高的催化剂是(填“m”或“n”)。

5B 2.0 | 6C 2.5 | 7N 3.0 | 8O 3.5 | 9F 4.0 |
13Al 1.5 | 14Si 1.8 | 15P 2.1 | 16S 2.5 | 17Cl 3.0 |
31Ga 1.6 | 32Ge 1.8 | 33As 2.0 | 34Se 2.4 | 35Br 2.8 |
下列含铝化合物属于离子化合物的是____(填标号)。
 )是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。
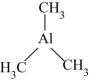
)是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。①三甲基铝分子中C原子的VSEPR模型为,Al原子的杂化轨道类型为。
②该物质可与胺类( , R表示烃基)结合,原因是。
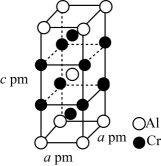
①该合鑫Cr-Al晶体的化学式为。
②用NA表示阿伏加德罗常数的值,则合金Cr-Al晶体的密度为(写出计算式即可,不要求化简)。
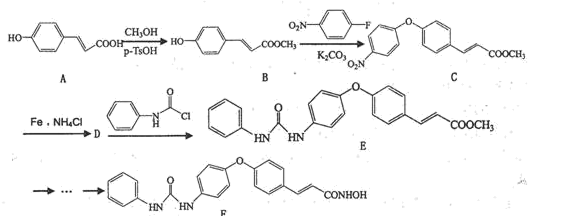
已知:①![]()
![]() ;
;
② +
+
 +H2O;
+H2O;
③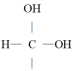 不稳定,易脱水转化为
不稳定,易脱水转化为 。
。
a.能发生取代反应和氧化反应 b.能与乙醇发生缩聚反应
c.可用酸性高锰酸钾溶液区分A和乙苯 d.1 mol A最多能中和2 mol NaOH
①苯环上有3个互为间位的取代基,且有一个为甲基;
②能与溶液发生显色反应;
③能发生水解反应,水解产物之一的分子式为。