①用绿矾(FeSO4· 7H2O)配制500mL 0.1mol/L的FeSO4溶液,需要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需使用(填仪器名称)。
②下列操作可能使所配溶液浓度偏大的是(填选项编号)。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线定容
C.配制溶液前容量瓶中有少量的蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
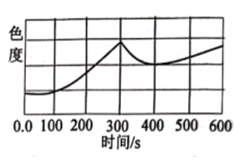
③FeSO4溶液露置在空气中颜色会加深,如图为该溶液露置在空气中,并在300s时加入10滴维生素C溶液,其色度(即颜色的色调和饱和度)随时间变化的图像,则维生素C导致溶液色度变化的原因是。

请回答下列问题:

a. b.
b. c.
c. d.
d.
资料:①SiHCl3 能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃)


若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,不需要的是 (填字母编号);装置B的作用是;对C中烧瓶加热至33.0℃左右的目是 ,让H2与SiHCl3在D装置中高温反应。
a. 分液漏斗 b.锥形瓶 c.酒精灯 d.漏斗 e.导管