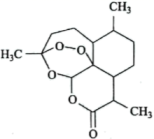
a.属于芳香族化合物 b.分子中含有酯基和醚键
c.其易溶于有机溶剂X,不易溶于水 d.其分子的空间结构不是平面形结构
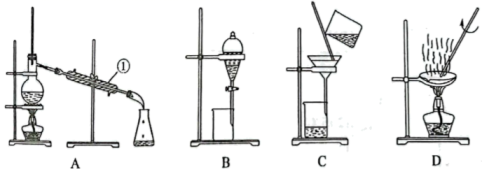
a.装置A中①的名称是。
b.从硫酸钡和硫酸钠的混合体系中分离出硫酸钡,可选择上述装置(填字母)。
c.碘水中提取碘单质可选用以下哪种试剂(填序号)。
①酒精 ②苯 ③乙酸 ④四氯化碳
①根据图1,可确定X的相对分子质量为74。

②根据图2,推测X可能所属的有机化合物类别和其分子式分别为、。

③根据以上结果和图3(两个峰且面积比为2:3),推测X的结构简式。

|
实验数据(mL)/滴定次数 |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V[NaOH(aq)](消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
①计算得:c(CH3COOH)=mol•L-1。
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)。
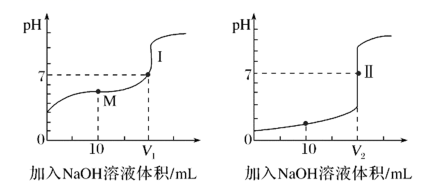
①滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是。
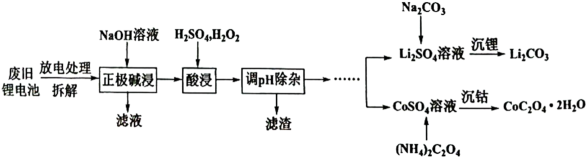
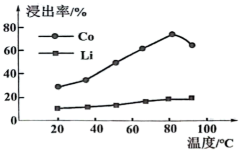
“酸浸”的适宜温度约为℃[所填数据限整数],若酸浸主要反应的化学方程式为: , 则上述反应过程中消耗的氧化剂与还原剂物质的量之比为。
