| 目的 | 方案设计 | 现象和结论 | |
| A | 探究镀锌铁皮的锌镀层是否已反应完全 | 将镀锌铁皮放入烧杯中,加入稀硫酸。用玻璃棒小心翻动镀锌铁皮,使其充分反应 | 若产生氢气的速率突然减小,则锌镀层已反应完全 |
| B | 探究某牙膏中是否含有甘油 | 取少量样品,加入适量蒸馏水,搅拌、静置,取上层清液,滴加适量新制 | 若有绛蓝色沉淀生成,则该产品中含有甘油 |
| C | 探究某溶液中有 | 向某溶液中滴加 | 若产生蓝色沉淀,则原溶液中有 |
| D | 探究淀粉水解程度 | 向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热至沸腾 | 若未出现红色物质,则淀粉未水解 |
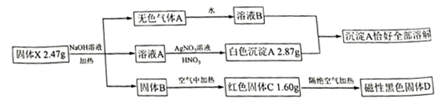
请回答:
组成X的四种元素为:Fe、Cl和(填元素符号),X的化学式为:。

室温下,在注射器中加入铁粉与硝酸,立即有气体产生,将气体通入装有空气的容器,无明显变化,点燃气体有尖锐的爆鸣声,容器壁出现无色液滴,该气体为。
副反应:
|
共价键 |
| | | |
| 键能 | 348 | 615 | 413 | 436 |
。
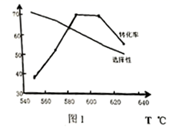
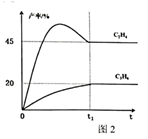
① 前,相同时间内,
的产率高于
的原因是。
② 时,主反应的平衡常数
。(保留2位有效数字)
③在下图3中绘制主、副的“能量~反应过程”示意图。


已知:①Zn及化合物的性质与Al及化合物的性质相似。
②阿司匹林铜的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂,受热不稳定,遇强酸解离为阿司匹林(  )和Cu2+。
)和Cu2+。
③阿司匹林铜的测定,用Na2S2O3滴定阿司匹林铜与KI生成的I2 , 涉及反应有:
;
;
。
回答下列问题:

①依次用蒸馏水、乙醇各洗涤2-3次 ②依次用乙醇、蒸馏水各洗涤2~3次
③小火烘干 ④自然晾干 ⑤蒸发浓缩、冷却结晶 ⑥蒸发结晶 ⑦过滤