
实验室用NH4Cl溶液和NaNO2溶液共热制备N2 , 装置A可选择(填标号)。

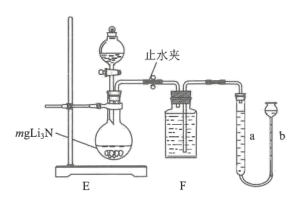
向圆底烧瓶中加水的操作是,。

相关金属离子[Co(Mn+ )=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Co2+ | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀的pH | 7.15 | 6.3 | 1.5 | 6.2 |
| 沉淀完全的pH | 9.15 | 8.3 | 2.8 | 8.2 |
回答下列问题:
A.KOH B.Zn(OH)2 C.ZnO D.Na2CO3

①写出一种既能加快化学反应速率,又能增大NO转化率的方法。
②图中T1T2(填“>”“<”或“=”)。
③温度为T1时,用NO表示t1~t2s内该反应的平均速率为,该反应的平衡常数K为,若NO的起始投入量为3amol,则达到平衡时NO的残留量为mol。

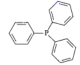 的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
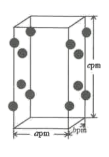
①晶胞中含有的Cl-数目为;
②若阿伏加德罗常数为NA , 则晶体的密度为g·cm-3.(列出计算式)