
①实验室用亚硫酸钠固体与70%硫酸制备SO2 , 不用稀硫酸的原因为。
②装置A、C除干燥气体外,另一作用是;装置D的作用为。
③仪器b的名称为;写出装置 E中发生反应的化学方程式:。
④仪器a中的试剂为。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为。
②实验室常用过量NaOH溶液吸收SOCl2 , 写出反应的离子方程式:。
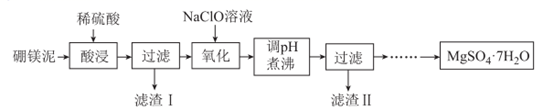
回答下列问题:
已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-890.3kJ·mol-1;
II.N2(g)+2O2(g)=2NO2(g)ΔH2=+67.7kJ·mol-1
则CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(l)ΔH=。
①该反应在(填“较高”或“较低”)温度下能自发进行。
②一定温度下,向2L恒容密闭容器中充入2molCH4(g)和2molNH3(g),发生上述反应,10min末达到平衡状态,测得NH3的体积分数为30%。则0~10min内,用HCN的浓度变化表示的平均反应速率为;CH4的平衡转化率为;该温度下,该反应的平衡常数K=(mol/L)2
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量随时间的变化如图1所示。活化能最小的是[填“E(A)”“E(B)”或“E(C)”]。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图2所示。温度高于300℃,处理NO2的量随温度升高而减小的原因为(假设该温度范围内催化效率相同)。

I.4FeS2+11O2 2Fe2O3+8SO2;
II.2SO2+O2 2SO3;
III.SO3+H2O=H2SO4。
回答下列问题:
②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:;含有12molσ键的K4[Fe(CN)6]的物质的量为mol。
③已知Fe2+半径为61pm,Co2+半径为65pm,则在隔绝空气条件下分别加热FeCO3和CoCO3 , FeCO3受热分解温度(填“低于”或“高于”)CoCO3。
②SO2中S原子的杂化方式为;SO3的立体构型为。第一电离能:SO(填“>”或“<”)。

①FeS2晶体中距离Fe2+最近的Fe2+的数目为。
②FeS2晶体的晶胞参数为anm,密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则FeS2的摩尔质量M=g·mol-1(用含a、ρ、NA的代数式表示)。