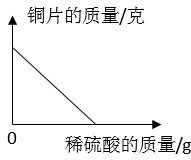
 B .
B .  C .
C . 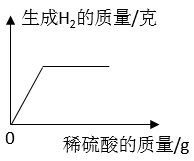 D .
D . 
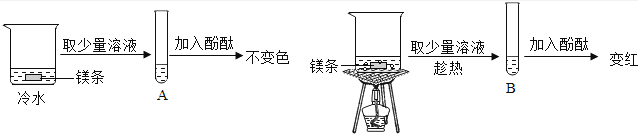
小明在学习金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?
【提出问题】镁是否能与水反应?
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图:
【反思与总结】
猜想 | 验证方案 |
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱 | 将褪色后的溶液 , 如果溶液变红,说明小明的猜想正确 |
小明通过实验证明了自己的猜想是正确的。
做“镁带在空气中燃烧”实验时,小科同学发现生成物中有少量黑色固体。黑色固体是镁和什么物质反应所产生的?他提出下列猜想:
猜想一:黑色固体可能是镁和氮气反应的产物;
猜想二:黑色固体可能是镁和二氧化碳反应的产物。
为了验证上述两个猜想,小科设想:

经思考发现,由于收集气体时相关气体的密度差异及C瓶冷却后瓶内外的气压差异,达不到预期效果。于是,他在老师的帮助下获得了这种气体,观察到镁带在该气体中燃烧并有淡黄色的固体产生;然后用D瓶收集一瓶 气体,把点燃的镁带放入D瓶中,观察到镁带在D瓶中也能燃烧,同时有白色固体和黑色固体生成。
通过以上实验,他得出结论:猜想正确。同时,他对燃烧有了新的认识:。
【提出问题】硫酸亚铁糖衣片中糖衣的作用是什么?
【查阅资料】a.亚铁离子遇具有氧化性的物质易被氧化成铁离子;
b.亚铁盐溶于水时,会水解产生少量氢氧根离子而产生Fe(OH)2沉淀;
c.硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物;
d.SO2能使高锰酸钾溶液褪色.
【探究一】利用废水回收铜,制备硫酸亚铁晶体并观察其在空气中的变化推断糖衣的作用.

实验中硫酸亚铁溶液中没有浑浊出现的原因可能是;
【探究二】某硫酸亚铁晶体(FeSO4•xH2O)热分解研究
Ⅰ.该兴趣小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值.

①硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液;装置B中硫酸铜粉末变蓝,质量增加12.6g;装置C中高锰酸钾溶液褪色.
②实验中要持续通入氮气的目的是.
③小明从理论上分析得出硫酸亚铁晶体分解还生成另一物质SO3 .
Ⅱ.某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量﹣﹣分解温度的关系图如图2.
①图2中T3至T4过程的化学反应方程式.
②计算FeSO4•xH2O中的x为.

①连接好装置;②检查装置气密性;③装入药品;④ ;⑤D 中黑色固体完全反应变成红色后,停止加热;⑥待 D 中玻璃管冷却至室温,关闭分液漏斗活塞;⑦数据处理。



【提出猜想】从物质组成元素的角度分析,放出的气体可能是SO2、O2、H2 .
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3 .
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
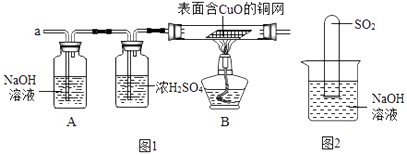
①甲同学认为是O2 , 收集一瓶该气体,检验方法是.
②乙同学认为是SO2 , 则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式.
③实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.如果放出的是O2和H2 , 你认为方案中的安全隐患是.
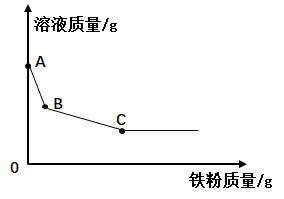
结论:铁粉与硫酸铜溶液反应时,产生的气体是.
①由上述实验可以推出,硫酸铜溶液中可能含有(选填:“酸性”、“碱性”或“中性”)物质.
②不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了图2所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是.要得到科学严谨的结论,仍利用该装置,补做的实验是
某工厂的工业废水中含有大量的FeSO4以及一定量的CuSO4和Na2SO4 , 为减少污染并变废为宝,某学习小组设计以下流程,拟从该废水中回收硫酸亚铁、金属铜,并利用氨碱法原理“制碱”.(除标注外,所加药品或试剂均过量,部分产物及反应条件略去)
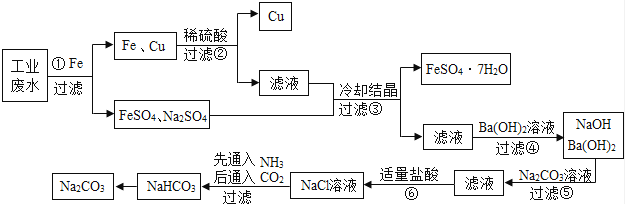
回答下列问题:

第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
