①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g6%的H2O2溶液,需要30%的H2O2溶液质量为g。
②配制:量取所需H2O2溶液和水于烧杯中,用(填仪器名称)搅拌,充分混合。

① 实验室用H2O2制取氧气的化学方程式为,可选择的发生装置为(填字母)
② 若用C装置干燥氧气,则C中盛放的试剂为。
③ 若用D装置收集氧气,则气体应从导管(填“a”或“b”)端通入。
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,下列发生装置能达到最佳效果的是(填字母)。

钠元素在自然界中分布很广,储量极为丰富,常以氯化钠、碳酸钠、硫酸钠等物质存在。
19世纪初,英国化学家戴维在实验室中首次制得了金属钠。
钠是一种银白色金属,质软,密度为0.97g·cm-3 , 熔点为97.8℃,金属钠的性质很活泼,能与许多物质发生化学反应。钠暴露在空气中,与氧气反应生成氧化钠(Na2O),钠在空气中燃烧,生成淡黄色的过氧化钠(Na2O2);钠遇水立即发生剧烈反应,生成氢氧化钠和氮气。因此,实验室常将钠保存在煤油中。
金属钠的用途广泛。钠和钾形成的合金熔点低,常温下呈液态,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下可以将钛(Ti)、锆(Zr)等稀有金属从其氯化物中置换出来。
工业上通常采用电解熔融氯化钠的方法制取单质钠。
a.导电性 b.导热性 c.延展性
天然气属于(填”可再生”或“不可再生”)能源。
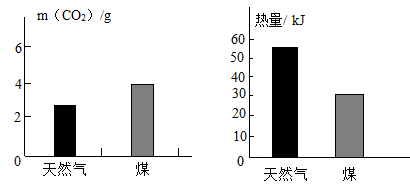
甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2。该反应的化学方程式为。
下列图标是我国“国家节水标志”的是(填字母)。

天然水净化为自来水的主要流程如下:
![]()
“沉降池”中可用明矾作混凝剂,其化学式为KAl(SO4)n·12H2O,n的值为。
废水中氨氮(以NH3形式存在)含量过高,直接排放会导致水体富营养化。次氯酸(HClO)可除去废水中的NH3 , 发生的反应为: 。X的化学式为,若废水碱性过强(pH>10),NH3的去除率会显著降低,原因是。

已知:铁与硫酸铁反应的化学方程式为 。
①写出铁与稀硫酸反应的化学方程式:。
②所用硫酸溶液浓度不能太稀,原因是。
④ 废铁屑中的少量Fe2O3不需要进行除杂处理,原因是。
已知:高锰酸钾与硫酸亚铁反应的化学方程式为
(相对分子质量;FeSO4-152,KMnO4-158)
取三块形状大小相近的石灰石(长宽厚约为 ),一块不加热,另两块分别在酒精灯和酒精喷灯(酒精化学式为C2H5OH)的火焰上加热2min(假设杂质加热时不发生变化)。探究过程如题28图所示,实验现象见表1。

表1不同条件下的实验现象
| 组别实验 | 实验条件 | 试管B中的现象 |
| 甲 | 未加热 | 无明显现象 |
| 乙 | 酒精灯加热 | 呈浅红色 |
| 丙 | 酒精喷灯加热 | 呈红色 |
通过甲、乙,丙三组对比实验,得出影响石灰石分解的因素是。
【查阅资料】生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用指定浓度的盐酸中和,记录所消耗盐酸的体积数(单位为mL),消耗盐酸的体积数越大,“活性度”越高。
某研究小组在电炉内煅烧石灰石样品,并测定煅烧产物(CaO)的活性度,数据见表2。
![]()
 表2不同条件下煅烧产物的活性度(mL)
表2不同条件下煅烧产物的活性度(mL)
| 煅烧温度 活性度 煅烧时间 | 1050℃ | 1100℃ | 1150℃ | 1200℃ | 1250℃ | 1300℃ |
| 12 min | 790 | 836 | 868 | 808 | 454 | 412 |
| 16 min | 793 | 856 | 871 | 845 | 556 | 530 |
| 20 min | 795 | 863 | 873 | 864 | 617 | 623 |
石灰石煅烧的最佳温度范围为1100~1200℃的证据是。
石灰石是高炉炼铁的原料之一。石灰石能除去铁矿石中的SiO2 , 同时能提高单位时间内生铁的产率。分析加入石灰石能提高生铁产率的原因:。