| 选项 | 实验方案 | 实验目的或结论 |
| A | 向20%蔗糖溶液中加入少量稀H2SO4 , 加热;再加入银氨溶液,未出现银镜 | 蔗糖未水解 |
| B | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入溴水中,褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 用两支试管各取5mL0.1mol·L-1的KMnO4溶液,分别加入2mL0.1mol·L-1和0.2mol·L-1的草酸溶液,记录溶液褪色所需的时间 | 探究浓度对化学反应速率的影响 |
| D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |


已知:Cu++Cl-=CuCl↓。回答下列问题:

|
微粒 |
H2S |
CH3COOH |
CH3COO- |
|
浓度/(mol·L-1) |
0.10 |
0.05 |
0.10 |
处理后的废水的pH=,c(Zn2+)=。[已知:Ksp(ZnS)=1.0×10-23 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-14 , Ka(CH3COOH)=2.0×10-5]
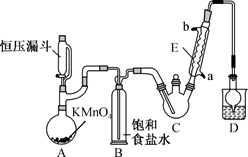
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| C2H5OH | 46 | ﹣114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | ﹣57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
| C2H5Cl | 64.5 | ﹣138.7 | 12.3 | 微溶于水,可溶于乙醇 |

则2SO2(g)+O2(g)⇌2SO3(g) ΔH3=。


①T3温度下反应速率最慢的原因是。
②T2温度时,反应达平衡时容器的体积为L,2SO2(g)+O2(g)⇌2SO3(g)的平衡常数K=。
③T2时使用V2O5进行反应:2SO2(g)+O2(g)⇌2SO3(g),反应达平衡后增大容器的体积同时再充入一定量的O2(g),在保证O2(g)的浓度不变,平衡(填标号)
A.向正反应方向移动 B.不移动 C.向逆反应方向移动 D.无法确定

导电基体上的单原子铜表面发生反应的方程式为。
①Fe的基态原子价电子排布式为。
②Ti的基态原子共有种不同能级的电子。
①上述化学方程式中非金属元素电负性由小到大的顺序是(用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为,COCl2分子的中心原子的杂化方式为。

①该晶体的化学式为。
②已知该晶胞的摩尔质量为Mg·mol-1 , 密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为。(NA可近似取6×1023 ,
=1.7)

已知: ![]()
![]()
请回答下列问题:
①相对分子质量比R多14;②能与金属Na反应放出氢气,但不与NaHCO3反应;③能发生银镜反应。
其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式为。(写出正确的一种即可)
 ,设计合成路线:。
,设计合成路线:。