 B .
B . 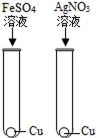 C .
C . 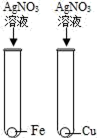 D .
D . 
| 名称 | 新鲜肉 | 次鲜肉 | 变质肉 |
| pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
| 选 项 | 物质(括号内为杂质) | 试 剂 | 操作方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | CO2(CO) | 足量的O2 | 点燃 |
| C | HCl(H2SO4) | 适量的氯化钡溶液 | 过滤 |
| D | NaCl(NaOH) | 适量的硫酸 | 蒸发结晶 |


(提出问题)红色固体是什么物质?
(查阅资料)①硫酸铜晶体或硫酸铜溶液为蓝色;无水硫酸铜是一种白色固体;温度达到200 ℃时,CuSO4开始分解生成CuO和另一种氧化物,反应过程中元素的化合价不变;
②温度超过1 000 ℃时,CuO分解生成红色的Cu2O;Cu2O难溶于水,但能与稀硫酸发生反应,生成Cu2+和Cu。
猜想2:红色固体是Cu2O;
猜想3:红色固体是;
猜想4:红色固体是Fe2O3。
通过讨论,同学们一致认为猜想4不成立,理由是。
。

|
Mg2+ |
Fe2+ |
Fe3+ |
|
|
开始沉淀 |
9.4 |
7.9 |
2.7 |
|
沉淀完全 |
12.4 |
9.6 |
3.7 |
流程“氧化”一步中H2O2的作用是将溶液中的Fe2+转化成Fe3+ , 不能直接沉淀Fe2+的原因是 。
①B操作中砝码与NaCl放颠倒了 ②D操作中仰视凹液面最低处读数;
③D操作中有少量水溅出 ④F操作中溶液洒落。