实验编号 | 1 | 2 | 3 | |
稀硫酸的质量分数 | 10% | 10% | 20% | |
溶液温度/℃ | 反应前 | 20 | 30 | 20 |
反应后 | 26 | 37 | 28 | |
反应所需时间 | 长 | 较短 | 较短 | |
【提出问题】汗水中产生咸味的物质是什么?
【制订计划】为了证明咸味物质是猜想中的那个物质,一是要证明汗水溶液中含有阴离子是(填写离子符号),二是要证明汗水溶液中有阳离子是(填写离子符号)。
【分析与交流】上述实验中,证明阴离子存在的化学反应方程式为: , 该反应属于复分解反应。
【提出问题】产生气体是什么物质?
【作出猜想】猜想一:可能是氧气;猜想二:可能是氢气;猜想三:可能是二氧化碳
实验步骤 | 现象 | 结论 |
①先用试管收集该气体,再将带火星的木条伸入试管 | 猜想一不成立 | |
②用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 | 该气体能燃烧,且玻璃片上有水雾出现 | 猜想二成立 |
【提出问题】两者是否发生了化学反应?
【实验探究】将盛有上述实验混合液的试管标为①,如图甲。
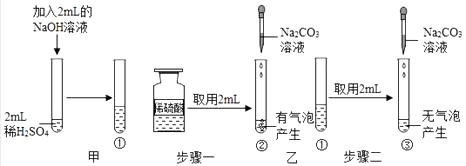
小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7。于是得出结论:。
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2mL,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论。
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理(选填“1”或“2”)。
