W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:.
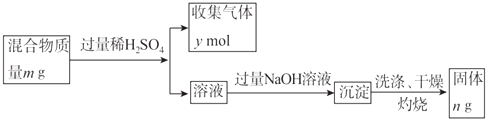
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
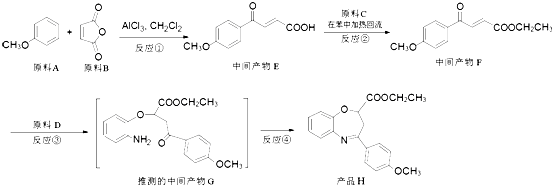
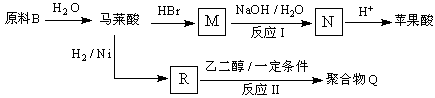
写出反应Ⅰ和反应Ⅱ的化学方程式:、.
(i)能发生银镜反应;
(ii)分子中含有三取代的苯环结构,其中两个取代基是:﹣COOCH3和 ![]() ,且二者处于对位.
,且二者处于对位.