【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
②了解到某些难溶性盐的溶解能力和颜色,其中AgI是一种难溶于水的黄色沉淀。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
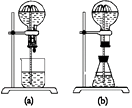
①在图(b)的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是_________。
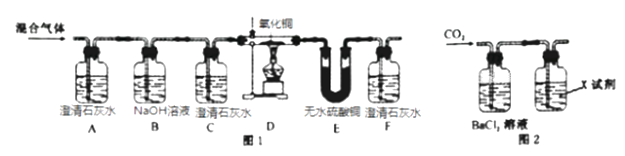 (查阅资料可知:CuO+H2
(查阅资料可知:CuO+H2![]() Cu+H2O;CuO+CO
Cu+H2O;CuO+CO![]() Cu+CO2 )
Cu+CO2 )
根据方案回答下列问题:

Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1 | 反应后总质量m2 |
371.84g | 371.24g |
回答下列问题: