① 太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g) △H1= +571.6kJ/mol
② 焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)= CO(g)+3H2(g) △H3=+206.1kJ/mol
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述错误的是( )(溶液体积变化忽略不计)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | а1 | а2 | а3 |
下列说法正确的是( )
①CO(g)+2H2(g) CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g)
CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=kJ·mol-1;已知ΔH2=-58 kJ·mol-1 , 则ΔH3=kJ·mol-1。
则乙烯和NO反应的热化学方程式: C2H4(g)+6NO(g)=2CO2(g)+3N2(g)+2H2O(l)ΔH= kJ·mol-1。
①相同条件下,在固定容积的密闭容器中选用不同的催化剂(a、b、c)发生反应:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。

下列说法错误的是(填序号)。
A 催化剂的催化效率:a>b>c
B X点时,NH3的化学反应速率为0.5 mol·L-1·min-1
C 达到平衡时,使用催化剂c时NO的转化率最小
D 若在恒容绝热的密闭容器中发生该反应,当K值不变时,说明反应已经达到平衡
②恒温恒容下,向容积为1.0 L的密闭容器中充入1.8 mol NH3和2.4 mol NO,在一定条件下发生反应,达到平衡时平衡体系的压强为反应前压强的 倍,则化学平衡常数K=(保留两位有效数字)。若上述反应改在恒温恒压条件下进行,则反应达到平衡时NH3的体积分数(填“变大”“变小”或“不变”)。
|
温度/℃ |
400 |
500 |
|
平衡常数K |
9 |
5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S(填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为。
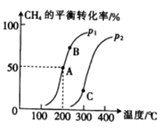
①200 ℃时,该反应的平衡常数K=。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是。
③压强:p1 (填“>”“<”或“=”)p2。